
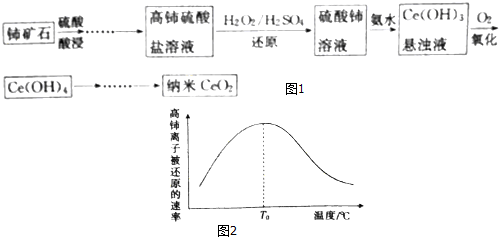
分析 铈矿石加入硫酸酸浸得到高铈硫酸盐,加入过氧化物稀硫酸还原高铈硫酸盐得到硫酸铈溶液,加入氨水生成Ce(OH)2沉淀,通入氧气氧化得到Ce(OH)4,分解得到CeO2,
(1)酸浸过程中,为了加快酸浸速率,可以升温、增大浓度、增大接触面积等措施加快浸出速率;
(2)过氧化氢还原高铈硫酸盐得到硫酸铈溶液;
(3)Ksp[Ce(OH)3]=1.0×10-20,当离子浓度≤1.0×10-5mol/L,认为离子沉淀完全,依据溶度积常数计算得到氢氧根离子浓度;
(4)氧化过程中Ce(OH)2沉淀通入氧气氧化得到Ce(OH)4,氧气为氧化剂,Ce(OH)2沉为还原剂,依据电子转移守恒计算氧化剂和还原剂物质的量之比;
(5)制备的CeO2是否为纳米级,溶于水利用胶体的丁达尔效应检验;
(6)过氧化氢在外地升高时会分解,还原剂浓度减小,反应速率减小;
(7)Fe2+将四价铈还原成Ce3+,Fe2+被氧化为Fe3+,根据电子转移守恒n[Ce(OH)4]=n[(NH4)2Fe(SO4)2],进而计算产品纯度.
解答 解:(1)将铈矿石粉碎或加热提高反应温度或适当增大硫酸的浓度等都可以加快酸浸速率,
故答案为:将铈矿石粉碎或加热提高反应温度或适当增大硫酸的浓度等;
(2)过氧化氢还原高铈硫酸盐得到硫酸铈溶液,
故答案为:将高铈硫酸盐还原;
(3)Ksp[Ce(OH)3]=c(Ce3+)c3(OH-)=1.0×10-20,当离子浓度≤1.0×10-5mol/L,c3(OH-)=$\frac{1.0×1{0}^{-20}}{1.0×1{0}^{-5}}$=1.0×10-15,
c(OH-)=1.0×10-5mol/L,c(H+)=$\frac{1{0}^{-14}}{1{0}^{-5}}$=10-9mol/L,需加入氨水调节溶液pH至少为9,
故答案为:9;
(4)氧化过程中,4Ce(OH)3+2H2O+O2=4Ce(OH)4,氧化剂与还原剂的物质的量之比为1:4,
故答案为:1:4;
(5)检验制备的CeO2是否为纳米级的方法是利用胶体的特征性质,将产品分散至水中,用一束强光照射,若产生丁达尔效应,则制备的CeO2为纳米级,
故答案为:用一束强光照射,若产生丁达尔效应,则制备的CeO2为纳米级;
(6)高铈离子被还原的速率与温度的关系如图2所示.图象中,温度高于T0时,高铈离子被还原的速率逐渐减小的原因是:温度越高,双氧水的分解速率越快,使得溶液中双氧水的浓度减小,反应速率减慢,
故答案为:温度越高,双氧水的分解速率越快,使得溶液中双氧水的浓度减小,反应速率减慢;
(7)①Fe2+将四价铈还原成Ce3+,Fe2+被氧化为Fe3+,根据电子转移守恒:n[Ce(OH)4]=n[(NH4)2Fe(SO4)2]=V×10-3L×cmol•L-1×$\frac{250ml}{20ml}$=0.0125cVmol,则m[Ce(OH)4]=208g/mol×0.0125cVmol=2.6cV g
故样品的纯度为$\frac{2.6cVg}{mg}$×100%=$\frac{2.6cV}{m}$×100%,
故答案为:$\frac{2.6cV}{m}$×100%;
②A.末用标准溶液润洗滴定管,标准溶液浓度减小,消耗体积增大,计算得到结果偏高,故A错误;
B.滴定前俯视计数,终点时仰视计数,测定标注溶液体积增大,测定结果偏高,故B错误;
C.锥形瓶残留有蒸馏水对测定结果无影响,故C错误;
D.用FeCl3溶液替代标准溶液进行滴定,氯离子还原四价铈还原成Ce3+,2Cl-~Cl2~2e-,氧化还原反应消耗氯化铁溶液体积减少,测定结果偏低,故答案为:D;
点评 本题考查了物质组成和成分的探究、物质的分离提纯方法、滴定实验过程分析和计算等,掌握基础是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3溶液中加入足量的NaOH浓溶液:NH4++OH-═NH3↑+H2O | |
| B. | 向FeBr2溶液中滴加少量氯水:2Fe2++Cl2═2Fe3++2Cl- | |
| C. | 用电子式表示HCl的形成过程: + + → → | |
| D. | 硫磺在空气中燃烧:2S+3O2$\frac{\underline{\;点燃\;}}{\;}$ 2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正戊烷与2,2-二甲基丙烷互为同分异构体 | |
| B. | 乙醇和二甲醚互为同分异构体 | |
| C. | 乙醇、乙二醇、丙三醇互为同系物 | |
| D. | 可用溴水来区分乙醇和苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用一定物质的量浓度的NaOH溶液滴定10.00mL已知浓度的盐酸,滴定结果如图1所示.回答下列问题:
用一定物质的量浓度的NaOH溶液滴定10.00mL已知浓度的盐酸,滴定结果如图1所示.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
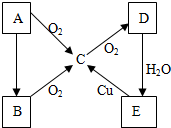 A、B、C、D、E五种物质在一定条件下的转化关系如图所示.
A、B、C、D、E五种物质在一定条件下的转化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
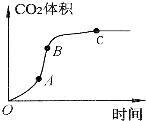 某学生用优质大理石与稀盐酸反应制取CO2,(不考虑反应过程中溶液体积的变化),实验结果如图所示,下列说法错误的是( )
某学生用优质大理石与稀盐酸反应制取CO2,(不考虑反应过程中溶液体积的变化),实验结果如图所示,下列说法错误的是( )| A. | AB段反应速率最快的原因可能是反应放热,体系温度升高 | |
| B. | BC段反应速率变慢的原因可能是盐酸浓度降低 | |
| C. | 该反应速率也可以用CaCl2的浓度变化与时间关系来表示 | |
| D. | C点后CO2体积不变的原因一定是大理石消耗完 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com