
| A. | 1mol/L | B. | 1.5mol/L | C. | 3mol/L | D. | 7mol/L |
分析 100mL 2mol/L的AlCl3溶液中氯化铝的物质的量=0.1L×2mol/L=0.2mol,若Al元素都转化为氢氧化铝沉淀,则氢氧化铝物质的量为0.2mol>0.1mol,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,结合方程式计算消耗氢氧化钠物质的量,进而计算NaOH溶液的物质的量的浓度.
解答 解:100mL 2mol/L的AlCl3溶液中氯化铝的物质的量=0.1L×2mol/L=0.2mol,若Al元素都转化为氢氧化铝沉淀,则氢氧化铝物质的量为0.2mol>0.1mol,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2.
①若碱不足,由Al3++3OH-═Al(OH)3↓可知,NaOH的物质的量为0.1mol×3=0.3mol,则c(NaOH)=$\frac{0.3mol}{0.1L}$=3mol/L,
②沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,则:
Al3++3OH-═Al(OH)3↓
0.2mol 0.6mol 0.2mol
Al(OH)3+OH-═AlO2-+2H2O
(0.2-0.1)mol (0.2-0.1)mol
则消耗的碱的物质的量为0.6mol+(0.2-0.1)mol=0.7mol,则c(NaOH)=$\frac{0.7mol}{0.1L}$=7mol/L,
故选:CD.
点评 本题考查方程式的有关计算,涉及过量计算问题,难度中等,关键是根据氯化铝与氢氧化铝的量判断发生的反应,再结合反应的有关方程式计算.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA | |
| B. | 100g质量分数为98%的浓硫酸中所含氧原子数为4NA | |
| C. | 常温常压下,92gNO2N2O4的混合气体含有的原子数为6NA | |
| D. | 44gN2O和CO2组成的混合气体中含有NA个分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M•NA | B. | Mg/mol | C. | $\frac{M}{{N}_{A}}$g/mol | D. | M•NA g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
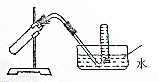 如图装置可用于( )
如图装置可用于( )| A. | 加热NaHCO3制CO2 | B. | 用Cu和稀HNO3反应制NO | ||
| C. | 用NH4Cl与浓NaOH溶液反应制NH3 | D. | 用NaCl于浓H2SO4反应制HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉的有效成分是CaCl2 | |
| B. | 漂白粉和明矾处理自来水的原理是相同的 | |
| C. | 漂白粉最好在弱酸性环境下使用 | |
| D. | 漂白粉因易在空气中氧化而密封保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 分类标准 | 能导电的物质 | 电解质 | 能电离出H+的物质 |
| 属于该类的物质 | a、g、h | b、c、e、f、h | b、c、g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com