
【题目】酯类化合物G是一种香料,以丙酮为初始原料合成该有机物的流程如下图所示(部分产物及反应条件已略去):
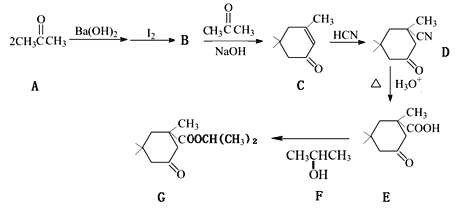
已知:![]()
(1)B的结构简式为______________,F的名称是__________。
(2)C中含氧官能团的名称是______________。
(3)C转化成D的反应类型_________________。
(4)D的分子式为_______________________。
(5)E转化成G的化学方程为________________。
(6)芳香化合物H比C少两个氢原子,能与氯化铁溶液反应显紫色且苯环上的一氯代物只有一种,写出满足上述条件的H的所有同分异构体的结构简式__________。H的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是____(填序号)。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
(7)设计以CH3CH2CH2OH为起始原料制备2-甲基丙酸(![]() )的合成路线__(无机试剂任选)。
)的合成路线__(无机试剂任选)。
【答案】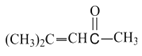 2-丙醇(或异丙醇) 羰基 加成反应 C10H15NO
2-丙醇(或异丙醇) 羰基 加成反应 C10H15NO  +H2O
+H2O 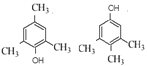 c CH3CH2CH2OH
c CH3CH2CH2OH![]() CH3CH=CH2
CH3CH=CH2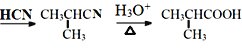
【解析】
根据给定的已知信息可知,A经过转化得到B的结构简式为:![]() ,B与
,B与![]() 在氢氧化钠作用下生成
在氢氧化钠作用下生成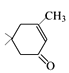 ,
, 与HCN发生加成反应生成D(
与HCN发生加成反应生成D(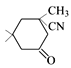 ),D在酸性条件下水解-CN转化为-COOH,E与F 发生酯化反应生成G,据此分析作答。
),D在酸性条件下水解-CN转化为-COOH,E与F 发生酯化反应生成G,据此分析作答。
根据上述分析可知,
(1)B的结构简式为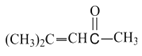 ;F中的官能团为羟基,其名称是2-丙醇(或异丙醇);
;F中的官能团为羟基,其名称是2-丙醇(或异丙醇);
(2)C的结构简式为: 其中含氧官能团的名称是羰基;
其中含氧官能团的名称是羰基;
(3)C与HCN反应转化成D,碳碳双键变单键,其反应类型为加成反应;
(4)D的结构简式为 ,其分子式为C10H15NO;
,其分子式为C10H15NO;
(5)E和F发生酯化反应转化成G,反应条件为浓硫酸加热,其化学方程为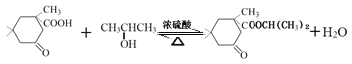 ;
;
(6)C的分子式为C9H14O,H比C少两个氢原子,H的分子式为C9H12O,H的不饱和度为![]() =4,属于芳香化合物,能与氯化铁溶液反应显紫色,说明含有酚羟基,且苯环上的一氯代物只有一种,说明苯环上只有一种环境的氢原子,则H的所有同分异构体的结构简式为
=4,属于芳香化合物,能与氯化铁溶液反应显紫色,说明含有酚羟基,且苯环上的一氯代物只有一种,说明苯环上只有一种环境的氢原子,则H的所有同分异构体的结构简式为 ;
;
a. H的这两种同分异构体,因为各分子碎片不同,其质荷比不同,所以中间部分的峰不相同,则质谱仪检测的信号不同,a项错误;
b. 两种同分异构体在红外光谱仪中显示的化学键和官能团有所不同,b项错误;
c.元素分析仪是分析元素组成的仪器,这两种物质互为同分异构体,分子式相同,则显示的信号(或数据)完全相同,c项正确;
d.核磁共振仪是测定等效氢原子的种类与数目比以及化学位移,d项错误;
答案选c;
(7)模仿C转化到E的过程可以设计,先将CH3CH2CH2OH在浓硫酸作用下发生消去反应生成1-丙烯,然后和HCN发生加成反应,最后再在酸性条件下得到目标产物2-甲基丙酸(![]() ),其具体的合成路线为:
),其具体的合成路线为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. Na与H2O的反应是熵增的放热反应,该反应能自发进行
B. 向2支盛有2 mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液,一支试管中产生黄色沉淀,另一支无明显现象,则可证明Ksp(AgI)<Ksp(AgCl)
C. Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s) ![]() Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
D. FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应PCl5(g)![]() PCl3(g)+Cl2(g),523K时,将10mol PCl5注入容积为2L的密闭容器中,平衡时压强为原来的1.5倍。
PCl3(g)+Cl2(g),523K时,将10mol PCl5注入容积为2L的密闭容器中,平衡时压强为原来的1.5倍。
(1)该温度下该反应的平衡常数K为________
(2)PCl5的平衡转化率为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素W、X、Y、Z的原子序数依次增大,且均不大于20。Y元素原子的最外层电子 数是内层电子数的3倍,Z元素原子的最外层电子数是最内层电子数的一半。甲是W、X两种元素形成的简单化合物,水溶液呈碱性,乙是Y元素的单质。在工业生产中它们有如下转化关系。下列叙述正确的是

A. 原子半径的大小W<X<Y<Z
B. 戊与丁反应过程中氧化剂与还原剂的物质的量之比为1:2
C. Y与Z形成的所有化合物中只存在离子键
D. X元素的氧化物对应的水化物均为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2SO2(g) + O2(g) ![]() 2SO3(g) △H =-akJ/mol(a>0),能量变化如图所示,下列说法不正确的是
2SO3(g) △H =-akJ/mol(a>0),能量变化如图所示,下列说法不正确的是

A. 2SO2(g) +O2(g) ![]() 2SO3(1) △H>-a kJ/mol
2SO3(1) △H>-a kJ/mol
B. 过程II可能使用了催化剂,使用催化剂不可以提高SO2的平衡转化率
C. 反应物断键吸收能量之和小于生成物成键释放能量之和
D. 将2molS02(g)和1 mol 02(g)置于一密闭容器中充分反应后放出的热量小于a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温、恒压下,1 mol A和1 mol B在一个容积可变的密闭容器中发生如下反应:A(g)+2B(g)![]() 2C(g)。一段时间后达到平衡,生成a mol C。下列说法不正确的是
2C(g)。一段时间后达到平衡,生成a mol C。下列说法不正确的是
A. 物质A、B的转化率之比一定是1:2
B. 起始时刻和达到平衡后容器中的压强比为1:1
C. 若起始放入3 mol A和3 mol B,则达到平衡时生成3a mol C
D. 当v(正)(A)=v(逆)(B)时,可断定反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2![]() O2+HbCO,37℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。下列结论错误的是( )
O2+HbCO,37℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。下列结论错误的是( )
A. CO与HbO2反应的平衡常数K=![]()
B. 当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
C. 人体吸入的CO越多,与血红蛋白结合的O2越少
D. 把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列应用与水解原理无关的是
A. 实验室盛放碳酸钠溶液的试剂瓶不能用玻璃塞
B. 泡沫灭火器用碳酸氢钠溶液和硫酸铝溶液,使用时只需将两者混合就可产生大量二氧化碳的泡沫
C. 浓硫化钠溶液有臭味
D. 可用碳酸钠与醋酸制取少量二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.25℃时,往25mL氢氧化钠标准溶液中逐滴加入0.2 mol·L-1的一元酸HA溶液,pH变化曲线如下图所示:
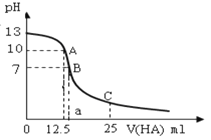
(1)该氢氧化钠溶液的物质的量浓度为________mol·L-1。
(2)A点对应酸的体积为12.5mL,则所得混合溶液中由水电离出的c(OH-)=_______ mol·L-1。
(3)NaA的水溶液显______性(选填“酸”、“碱”),原因是:________(用离子方程式表示)。
(4)在B点所得混合溶液中,c(Na+) 、c(A-)、c(H+)、c(OH-)由大到小的顺序是_________。
Ⅱ.在25 ℃的条件下,某些弱酸的电离平衡常数。
化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
(1)温度、浓度相同的CH3COOH和HClO溶液,水的电离程度前者________ 后者(填“>”“=”或“<”)。
(2)相同温度下,pH相同的NaClO和CH3COOK两种溶液中,c(CH3COOK)________c(NaClO) (填“>”“=”或“<”),[c(Na+)-c(ClO-)]_______[c(K+)-c(CH3COO-)](填“>”“=”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com