
| A. | 低温、高压、催化剂 | B. | 低温、低压、催化剂 | ||
| C. | 高温、高压、催化剂 | D. | 适宜温度、高压、催化剂 |
分析 该反应为气体体积缩小的反应,压强越大有利于氨气的生成;使用催化剂可以加快反应速率;该反应为放热反应,低温有利于氨气的生成,但是低温时反应速率较小,且催化剂在适当温度下才能更好的起到催化作用,需要选用适宜温度,据此进行解答.
解答 解:A.低温条件下,化学反应速率较慢,催化剂的催化活性受到影响,应该采用适宜温度,故A错误;
B.该反应为气体体积缩小的反应,高压有利于氨气的合成,且应该选用适宜温度,故B错误;
C.该反应为放热反应,高温下不利于氨气的合成,故C错误;
D.适宜的温度和压强下,可以提高反应物的转化率,使得催化剂的催化活性较高,让化学反应有利于正向进行,同时加入催化剂可以加快反应速率,故D正确;
故选D.
点评 本题考查了化学平衡及其影响,题目难度不大,正确判断工业合成氨的温度为解答关键,注意熟练掌握化学平衡及其影响,试题培养了学生的分析能力及灵活应用能力


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
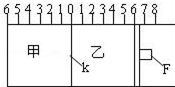 Ⅰ.如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)?2C(g); 反应达到平衡后,再恢复至原温度.回答下列问题:
Ⅰ.如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)?2C(g); 反应达到平衡后,再恢复至原温度.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
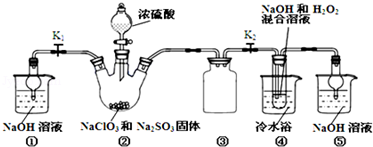
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤、蒸发、结晶、溶解 | B. | 溶解、蒸发、结晶、过滤 | ||
| C. | 溶解、蒸发、过滤、结晶 | D. | 溶解、过滤、蒸发、结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 主族元素的电负性越大,元素原子的第一电离能一定越大 | |
| B. | 在元素周期表中,元素电负性从左到右越来越小 | |
| C. | 在形成化合物时,电负性越小的元素越容易显正价 | |
| D. | 金属元素的电负性一定小于非金属元素的电负性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
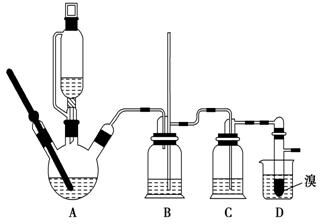 实验室制备1,2二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2═CH2+H2O CH2═CH2+Br2→BrCH2CH2Br
实验室制备1,2二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2═CH2+H2O CH2═CH2+Br2→BrCH2CH2Br| 乙醇 | 1,2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
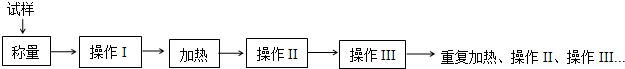
| 加热前质量 | 加热后质量 | ||
| m1 | m2 | m3 | m4 |
| 5.400g | 7.900g | 6.900g | 6.901g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅能表示化学反应中伴随放出热量多少的化学方程式 | |
| B. | 能够表示化学反应中热效应的化学方程式 | |
| C. | 热效应的大小与反应的温度、压强无关,只与反应物和生成物的状态有关 | |
| D. | 当多步反应中热化学方程式相加时,相对应的热量要相减 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com