
分析 (1)高锰酸钾与浓盐酸反应生成氯化钾、氯化锰、氯气、水;
(2)还原性Fe2+>Br-,所以向FeBr2溶液中通入少量Cl2时,Cl2先氧化Fe2+生成Fe3+;
(3)FeBr2溶液中通入过量Cl2,二者反应生成氯化铁、溴;
(4)NaHCO3过量,氢氧化钙完全反应,碳酸根离子有剩余;
氢氧化钙过量,碳酸氢根离子完全转化成碳酸钙沉淀,钙离子有剩余;
(5)Na2CO3溶液中逐滴加入稀盐酸,首先生成HCO3-,然后稀盐酸再和碳酸氢根离子反应最终生成二氧化碳气体.
解答 解:(1)高锰酸钾与浓盐酸反应生成氯化钾、氯化锰、氯气、水,离子方程式为2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O,
故答案为:2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O;
(2)还原性Fe2+>Br-,所以向FeBr2溶液中通入少量Cl2时,Cl2先氧化Fe2+生成Fe3+,离子方程式为Cl2+2Fe2+═2Fe3++2Cl-,
故答案为:Cl2+2Fe2+═2Fe3++2Cl-;
(3)FeBr2溶液中通入过量Cl2,二者反应生成氯化铁、溴,离子方程式为2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-,故答案为:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-;
(4)NaHCO3过量,氢氧化钙完全反应,碳酸根离子有剩余,离子方程式为Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O;
氢氧化钙过量,碳酸氢根离子完全转化成碳酸钙沉淀,钙离子有剩余,离子方程式为Ca2++HCO3-+OH-=CaCO3↓+H2O,
故答案为:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O;Ca2++HCO3-+OH-=CaCO3↓+H2O;
(5)Na2CO3溶液中逐滴加入稀盐酸,首先发生CO32-+H+=HCO3-,然后发生HCO3-+H+=CO2↑+H2O,所以看到的现象是先没有气体生成,一段时间后产生气泡,
故答案为:先没有气体生成,一段时间后产生气泡;CO32-+H+=HCO3-;HCO3-+H+=CO2↑+H2O.
点评 本题考查离子方程式的书写,为高频考点,明确离子反应先后顺序、物质性质、离子方程式书写规则是解本题关键,注意溴离子和亚铁离子还原性强弱,注意(5)题离子方程式书写与反应物的量有关,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
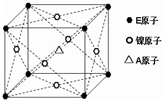 下表是元素周期表的一部分,表中所列字母分别代表一种元素(NA为阿伏加德罗常数的值).
下表是元素周期表的一部分,表中所列字母分别代表一种元素(NA为阿伏加德罗常数的值).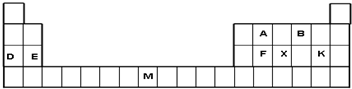
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+ | B. | Mg2+ | C. | Fe3+ | D. | Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Br-、I-、Cl- | B. | Cl-、Br-、I- | C. | I-、Br-、Cl- | D. | I-、Cl-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
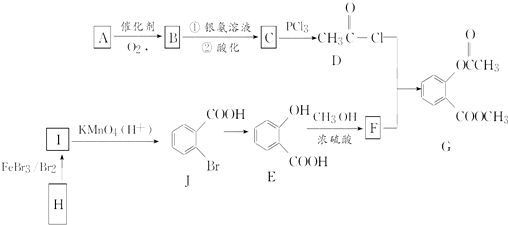
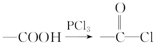
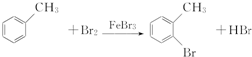 ,E→F的化学方程式为
,E→F的化学方程式为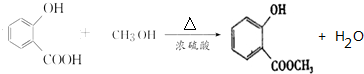 .
.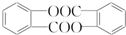 .
.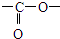 ”结构
”结构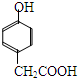 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com