
(7分)已知25℃时KW=1.0×10-14 试计算:
(1)计算室温条件下0.1mol/LHCl溶液中由水电离的氢离子浓度.
(2)计算室温条件下0.01mol/LNaOH溶液的pH.
(1)0.1mol/LHCl溶液中c(H+)=0.1mol/L,溶液中由水电离的氢离子浓度等于溶液中c(OH-),溶液中c(OH-)=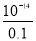 =10-13mol/L,故溶液中由水电离的氢离子浓度为10-13mol/L,答:溶液中由水电离的氢离子浓度为10-13mol/L;
=10-13mol/L,故溶液中由水电离的氢离子浓度为10-13mol/L,答:溶液中由水电离的氢离子浓度为10-13mol/L;
(2)0.01mol/LNaOH溶液中(OH-)=0.01mol/L,溶液中c(H+)= =10-12mol/L,故溶液pH=-lg10-12=12,答:室温条件下0.01mol/LNaOH溶液的pH=12
=10-12mol/L,故溶液pH=-lg10-12=12,答:室温条件下0.01mol/LNaOH溶液的pH=12
【解析】
试题分析:(1)盐和碱都抑制水的电离,由水电离出的氢离子浓度等于由水电离出来的氢氧根离子根离子浓度,0.1mol/LHCl溶液中c(H+)=0.1mol/L,溶液中由水电离的氢离子浓度等于溶液中c(OH-),溶液中c(OH-)=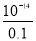 =10-13mol/L,故溶液中由水电离的氢离子浓度为10-13mol/L;(2)0.01mol/LNaOH溶液中(OH-)=0.01mol/L,根据Kw计算溶液中c(H+),溶液中c(H+)=
=10-13mol/L,故溶液中由水电离的氢离子浓度为10-13mol/L;(2)0.01mol/LNaOH溶液中(OH-)=0.01mol/L,根据Kw计算溶液中c(H+),溶液中c(H+)= =10-12mol/L,故溶液pH=-lg10-12=12。
=10-12mol/L,故溶液pH=-lg10-12=12。
考点:考查物质的量的相关计算。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、该原子的摩尔质量是aNAg?mol-1 | ||
B、Wg该原子的物质的量是
| ||
C、Wg该原子中含有
| ||
D、由已知信息可得:NA=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ |
| B、2Fe2++Cl2═2Fe3++2Cl- |
| C、I2+SO2+2H2O═H2SO4+2HI |
| D、H2O2+H2SO4═SO2+O2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X3YZ4 |
| B、X4YZ4 |
| C、XYZ2 |
| D、X2YZ4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省高二上学期期末考试化学试卷(解析版) 题型:选择题
常温下,Ksp(CaSO4)=9×l0-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图。下列判断错误的是
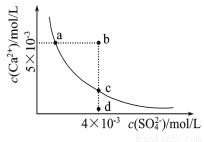
A.a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液
B.a点对应的Ksp等于c点对应的Ksp
C.向d点溶液中加入适量CaCl2固体可以变到c点
D.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×l0-3mol/L
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省高二上学期期末考试化学试卷(解析版) 题型:选择题
下列说法中正确的是
A、1s22s12p1表示的是激发态原子的电子排布
B、元素的发射光谱一般是亮背景、暗线、线状不连续
C、同一原子中,1s,2s,3s电子的能量逐渐减小
D、各能层的能级都是从s能级开始至f能级结束
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省高二上学期期末考试化学试卷(解析版) 题型:选择题
某一反应物在一定条件下的平衡转化率为25.3%,当使用了催化剂时,其转化率为
A.大于25.3% B.小于25.3% C.等于25.3% D.不能确定
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省高二上学期期中化学(理)试卷(解析版) 题型:填空题
(18分)下表为长式周期表的一部分,其中的编号代表对应的元素。

试填空。
(1)写出元素D与A形成的化合物的电子式 ,该化合物分子的空间构型是 ,其中元素D的杂化方式为 。
(2)J的离子结构示意图 ;K元素在周期表的位置 。元素L基态原子的电子排布式 。
(3)E、H、I 这三种元素的第一电离能由大到小的顺序是(填对应的元素符号) ;
(4)由D、J的氢化物相互作用所生成的物质所含化学键有下列的 。
A、离子键
B、非极性键
C、极性键
D、金属键
E、配位键
(5)用氢键表示式写出F的氢化物水溶液中所有氢键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com