
| A. | 全氟丙烷不能使溴水褪色 | |
| B. | 全氟丙烷的电子式为: | |
| C. | 相同压强下,沸点:C3F8<C3H8 | |
| D. | 分子中三个碳原子可能处于同一直线上 |
分析 A.含有碳碳不饱和键、醛基、苯环上酚羟基邻对位含有氢原子的酚能使溴水褪色;
B.该分子中每个F原子还含有3个孤电子对;
C.分子晶体熔沸点与相对分子质量成正比;
D.全氟丙烷相当于四氟甲烷分子中的一个F原子被-CF2CF3取代.
解答 解:A.该物质中不含碳碳不饱和键、醛基,不能和溴水反应而使溴水褪色,故A正确;
B.该分子中每个F原子还含有3个孤电子对没有标出,故B错误;
C.分子晶体中,熔沸点与相对分子质量成正比,所以相同压强下,沸点:C3F8>C3H8,故C错误;
D.全氟丙烷相当于四氟甲烷分子中的一个F原子被-CF2CF3取代,四氟甲烷是正四面体结构,所以全氟丙烷中三个碳原子不可能处于同一直线上,故D错误;
故选A.
点评 本题考查晶体熔沸点高低判断、分子结构、有机物的结构和性质等知识点,侧重考查学生分析判断能力,会利用知识迁移方法解答问题,易错选项是B.


科目:高中化学 来源: 题型:选择题
| A. | 单质的熔沸点逐渐降低 | B. | 卤素离子的还原性逐渐增强 | ||
| C. | 最高正化合价逐渐增大 | D. | 单质的氧化性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M<N<Y<X<Z | B. | N<M<X<Y<Z | C. | N<M<Y<X<Z | D. | X<Z<N<M<Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
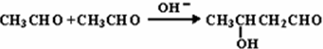
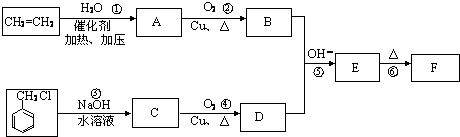
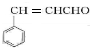 .E中含氧官能团的名称为醛基、羟基.
.E中含氧官能团的名称为醛基、羟基.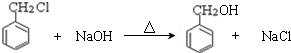
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
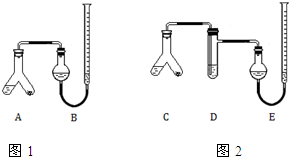 某实验小组分别用图1、2装置测定某种钙片中碳酸钙的含量,夹持装置已略去.
某实验小组分别用图1、2装置测定某种钙片中碳酸钙的含量,夹持装置已略去.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
| 实验序号 | 反应温度/℃ | H2C2O4溶液 | 酸性KMO4溶液 | H2O | ||
| V/mL | c/(mol•L-1) | V/mL | c/(mol•L-1) | V/mL | ||
| ① | 25 | 8.0 | 0.20 | 5.0 | 0.010 | 0 |
| ② | 25 | 6.0 | 0.20 | 5.0 | 0.010 | x |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
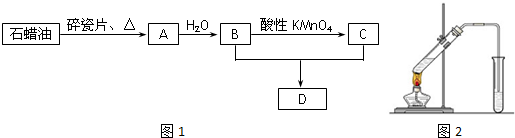
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+S$\frac{\underline{\;\;△\;\;}}{\;}$CuS | B. | 3Cu+8HNO3(浓)═3Cu(N03)2+2N0↑+4H20 | ||
| C. |  +HO-NO2$\stackrel{浓硫酸}{→}$ +HO-NO2$\stackrel{浓硫酸}{→}$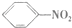 +H2O +H2O | D. | 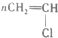 $\stackrel{引发剂}{→}$ $\stackrel{引发剂}{→}$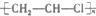 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol R(g)的能量总和大于1 mol M(s)与1 mol N(g) 的能量总和 | |
| B. | 将2 mol R (g)与1 mol N(g)在该条件下充分反应,放出热量Q2 kJ | |
| C. | 当1 mol M(s) 与N(g)完全转化为T (g)时(假定无热量损失),放出热量Q1+$\frac{{Q}_{2}}{2}$kJ | |
| D. | M(g)+N(g)?R(g)△H=-Q3 kJ•mol-1,则Q3<Q1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com