
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源:不详 题型:填空题
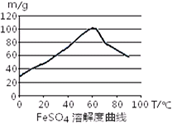
| A.浓硫酸 | B.10moL/L硫酸 | C.3moL/L硫酸 | D.任意浓度硫酸; |
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe3+的氧化性比溴的氧化性强 |
| B.该晶体中一定含有SCN- |
| C.Fe2+与SCN-不能形成红色化合物 |
| D.Fe2+被溴氧化成Fe3+ |
查看答案和解析>>
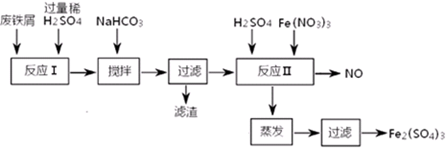
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe2+,一定不含Cu2+ |
| B.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe2+,可能含有Cu2+和Fe3+ |
| C.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe3+和Fe2+,一定不含Cu2+ |
| D.若滤出的固体中含有铁和铜,则溶液中一定含有的阳离子是Fe2+,一定不含Cu2+和Fe3+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
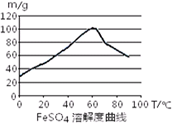
| A.浓硫酸 | B.10moL/L硫酸 | C.3moL/L硫酸 | D.任意浓度硫酸; |
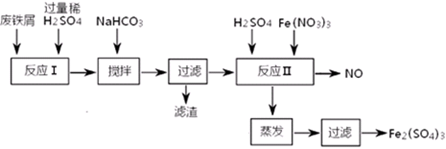
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
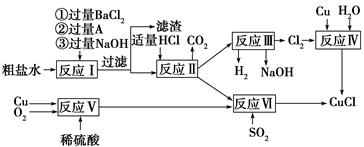
科目:高中化学 来源:不详 题型:填空题
| | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀 完全时的pH |
| Fe3+ Fe2+ | 1.9 7.0 | 3.2 9.0 |
| Cu2+ | 4.7 | 6.7 |
| 提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu | ||
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
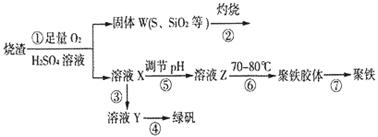
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
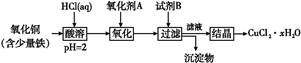
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com