
【题目】化学与生产、生活息息相关,下列叙述错误的是
A. 二氧化硫可广泛用于食品的增白
B. 小苏打是面包发酵粉的主要成分之一
C. 燃烧化石燃料是造成雾霾天气的一种重要因素
D. 硅胶可用作食品干燥剂
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】升高温度时,化学反应速率加快,主要是由于( )
A.分子运动速率加快,使反应物分子间的碰撞机会增多
B.反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多,化学反应速率加快
C.该化学反应的过程是吸热的
D.该化学反应的过程是放热的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化合物:①Na2O2、②Fe(OH)3、③FeCl2、④CuS、⑤H2SiO3、⑥NaHCO3,其中不能通过化合反应制得的有几项?
A. 一项 B. 二项 C. 三项 D. 四项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气的制取与储存是氢能源利用领域的研究热点。回答下列问题:
(1)直接热分解法制氢
某温度下2H2O(g) ![]() 2H2(g) +O2(g),该反应的平衡常数表达式为 K= ________。
2H2(g) +O2(g),该反应的平衡常数表达式为 K= ________。
(2)乙醇水蒸气重整制氢
反应过程和反应的平衡常数(K)随温度(T)的变化曲线如图 1 所示。某温度下,图 1 所示反应每生成1mol H2(g),热量变化是 62 kJ,则该反应的热化学方程式为________________
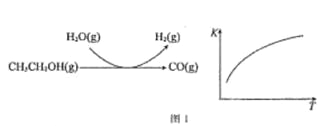
(3)水煤气法制氢
CO(g)+ H2O(g) ![]() CO2(g) +H2(g) △H<0,在进气比[n(CO):n(H2O)]不同时,测得相应的 CO 的平衡转化率见图 2(图中各点对应的反应温度可能相同,也可能不同)。
CO2(g) +H2(g) △H<0,在进气比[n(CO):n(H2O)]不同时,测得相应的 CO 的平衡转化率见图 2(图中各点对应的反应温度可能相同,也可能不同)。
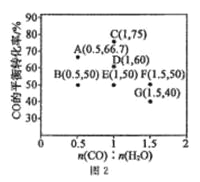
①向 2 L 恒温恒容密闭容器中加入一定量的 CO 和 0.1mol H2O(g),在图中 G 点对应温度下,反应经5 min 达到平衡,则平均反应速率 v(CO)=___________。
②图中 B、E 两点对应的反应温度分别为 TB 和 TE,则 TB ___________TE (填“>”“ <”或“=”)。
③经分析,A、E、G 三点对应的反应温度都相同(均为 T℃),其原因是 A、E、G 三点对应的 _______相同。
④当 T℃时,若向一容积可变的密闭容器中同时充入 3.0 mol CO、1.0 mol H2O(g)、1.0 molCO2 和xmol H2,使上述反应开始时向正反应方向进行,则x应满足的条件是_________。
(4)光电化学分解制氢

反应原理如图3,钛酸锶光电极的电极反应式为 4OH--4e-=O2↑+2H2O,则铂电极的电极反应式为 ________。
(5)Mg,Cu 是一种储氢合金
350℃时,Mg、Cu 与 H2 反应,生成 MgCu2 和仅含一种金属元素的氢化物(其中氢的质量分数约为 7.7%)。该反应的化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列反应方程式:
①CH3-CH2-Br与氢氧化钠溶液在加热条件下的反应方程式 ___________________________________。
②乙醛与银氨溶液水浴加热条件下的反应方程式___________________________________。
③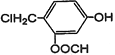 与NaOH溶液在加热条件下的化学反应方程式___________________________________。
与NaOH溶液在加热条件下的化学反应方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下实验能获得成功的是( )
A.用稀硫酸与乙醇混合液共热控制在170℃制乙烯气体
B.将铁屑、溴水、苯混合制溴苯
C.在苯酚溶液中滴入少量稀溴水出现白色沉淀
D.将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】㈠乳酸是一种体内代谢物,其结构简式为CH3﹣CH(OH)﹣COOH,试回答:
(1)乳酸分子中含有的官能团是_____ 和_____.(填名称)
(2)乳酸不能发生的反应是_____(填序号)
A.酯化反应 B.取代反应 C.加成反应 D.消去反应.
㈡300多年前,著名化学家波义耳发现了铁盐与没食子酸的显色反应,并由此发明了蓝黑墨水.没食子酸的结构式为:

(1)用没食子酸制造墨水主要利用了_____类化合物的性质.(填代号)
A.醇 B.酚 C.醛 D.羧酸
(2)写出没食子酸与氢氧化钠溶液共热反应的化学方程式:_______________.
㈢在①CH2=CH2 ②![]() ③CH3CH2OH ④CH3COOH ⑤聚乙烯五种物质中:
③CH3CH2OH ④CH3COOH ⑤聚乙烯五种物质中:
(1)属于高分子化合物的是_____;(请填物质的序号,下同.);
(2)能使Br2的CCl4溶液褪色的是_____;
(3)既能发生取代反应又能发生加成反应的是_____;
(4)能与Na2CO3溶液反应的是_____;
(5)能发生酯化反应的是_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“酒是陈的香”就是因为酒在贮存过程中生成了有香味的乙酸乙酯。在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题。

(1)乙烯制取乙醇的化学方程式:__________________________。
(2)写出制取乙酸乙酯的化学反应方程式:________________________。
(3)浓硫酸的作用:_______________________________。
(4)饱和碳酸钠溶液的主要作用是________________________________________。
(5)装置中导管要在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是__________。
(6)若要把制得的乙酸乙酯分离出来,应该采用的实验操作是___________________。
(7)做此实验时,有时还要向盛有乙酸乙酯的试管里加入几块碎瓷片,其目的是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com