
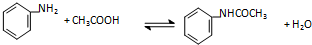
| 物质 | 相对分子质量 | 熔点(℃) | 沸点 | 溶解度(g) | |
| 水 | 乙醇 | ||||
| 苯胺 | 93 | -6 | 184 | 3.42(20℃) | 任意比混溶 |
| 乙酸 | 60 | 17 | 117.9 | 任意比混溶 | 任意比混溶 |
| 乙酰苯胺 | 135 | 114 | 304 | 0.56(20℃) 3.45(50℃) 5.20(100℃) | 36.9(20℃) |

分析 5.0ml苯胺、7.4ml冰醋酸、0.10g锌粒混合加热至沸腾30min,趁热倒入水中析出晶体,抽滤洗涤干燥得到粗产品,重结晶得到较纯净的产品,
(1)加入锌粒的目的是和酸反应生成氢气,在氢气环境中避免苯胺被氧化,韦氏分馏柱作用冷凝回流乙酸和苯胺;
(2)由物质铵的沸点可知,这几种反应物和生成物在105℃的条件下,只能蒸出H2O;
(3)因为在水中,相比而言,乙酰苯胺的溶解度较小,所以可以用来洗去未反应的乙酸和苯胺,同时降低乙酰苯胺的溶解度,促使其析出;
(4)乙酰苯胺在冷水中的溶解度会更小;
(5)避免晶体在过滤过程中有损失,所以要趁热过滤、冷去结晶;
(6)结合化学方程式计算乙酰苯胺的理论产量,进而计算制备过程的产率=$\frac{实际产量}{理论产量}$×100%.
解答 解:(1)苯胺易被氧化,锌和醋酸反应生成氢气提供氢气环境防治苯胺被氧化,韦氏分馏柱作用的是冷凝回流乙酸和苯胺,提高原料的利用率,
故答案为:制备氢气防止苯胺被氧化;冷凝回流乙酸和苯胺,提高原料的利用率;
(2)由物质的沸点可知,这几种反应物和生成物在105℃的条件下,只能蒸出H2O,故锥形瓶中收集到的馏分主要是H2O,故答案为:H2O;
(3)因为在水中,相比而言,乙酰苯胺的溶解度较小,所以可以用来洗去未反应的乙酸和苯胺,同时降低乙酰苯胺的溶解度,促使其析出,
故答案为:洗去未反应的乙酸和苯胺,同时降低乙酰苯胺的溶解度,促使其析出;
(4)乙酰苯胺在冷水中的溶解度会更小,应选择冷水,
故答案为:A;
(5)步骤4重结晶的过程:粗产品溶于沸水中配成饱和溶液→再加入少量蒸馏水→加入活性炭脱色→加热煮沸→趁热过滤→冷却结晶→抽滤→洗涤→干燥,避免晶体过滤过程中有损失,所以要趁热过滤,
故答案为:趁热过滤;冷却结晶;
(5)依据化学方程式: ,可知乙酰苯胺的理论产量为:0.055mol×135g/mol=7.425g因此,上述制备过程的产率是:$\frac{2.62g}{7.425g}$×100%=35.29%,
,可知乙酰苯胺的理论产量为:0.055mol×135g/mol=7.425g因此,上述制备过程的产率是:$\frac{2.62g}{7.425g}$×100%=35.29%,
故答案为:35.29%.
点评 本题考查有机物的合成、有机化学实验,侧重考查学生对数据的分析处理能力,是对学生综合能力的考查,需要学生具备扎实的基础,难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
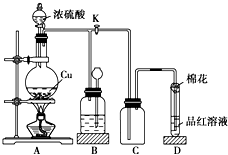 某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验.请回答:
某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
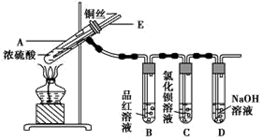
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 | BaSO4 | BaSO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 名称 | 相对分子质量 | 性状 | 熔点/℃ | 溶解度 | |
| 水 | 乙醇 | ||||
| 甲苯 | 92 | 无色液体易烯易挥发 | -95 | 不溶 | 易溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4(100℃升华) | 25℃0.35g 80℃2.7g | 易溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
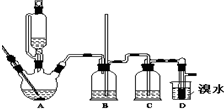 实验室制备1,2二溴乙烷的反应原理如下:
实验室制备1,2二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com