
| pH | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Ti(OH)2 |
| 开始沉淀 | 1.1 | 4.5 | 7 | 1 |
| 完全沉淀 | 2.8 | 6.4 | 9.2 | 2.7 |
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
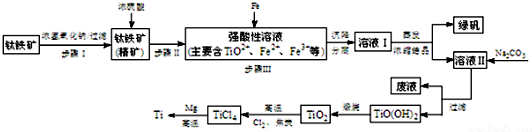
分析 钛铁矿先用浓氢氧化钠溶液溶解,Al2O3、SiO2发生反应,过滤分离,钛铁矿精矿用浓硫酸溶解得到强酸溶液中主要含有TiO2+、Fe2+、Fe3+等,加入过量铁粉还原铁离子,过滤得到滤液通过蒸发浓缩、冷却结晶得到绿矾,过滤得到溶液中主要含有TiO2+、Fe2+、H+等离子,再加入碳酸钠析出TiO(OH)2,加热煅烧得到TiO2,加入氯气、过量碳高温反应生成TiCl4和一氧化碳,四氯化钛和金属镁高温加热反应得到氯化镁和钛金属.
(1)步骤I中氧化铝与氢氧化钠反应生成偏铝酸钠与水,二氧化硅与氢氧化钠反应生成硅酸钠与水;
(2)a.由溶度积可知,步骤II加入铁屑,将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀;
b.溶液Ⅱ中大量含有的阳离子有 TiO2+、Fe2+、H+;
(3)①TiO2与氯气、过量碳高温加热反应生成TiCl4和一氧化碳;
②TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,采用真空蒸馏的方法分离得到Ti,由物质的熔沸点,可知应加热使Mg、MgCl2转化为蒸汽,而Ti不能转化为蒸汽;
(4)根据离子方程式计算25mL溶液中FeSO4的物质的量,再计算2.850g样品中FeSO4•7H2O的质量,进而计算样品中FeSO4•7H2O的质量分数.
解答 解:钛铁矿先用浓氢氧化钠溶液溶解,Al2O3、SiO2发生反应,过滤分离,钛铁矿精矿用浓硫酸溶解得到强酸溶液中主要含有TiO2+、Fe2+、Fe3+等,加入过量铁粉还原铁离子,过滤得到滤液通过蒸发浓缩、冷却结晶得到绿矾,过滤得到溶液中主要含有TiO2+、Fe2+、H+等离子,再加入碳酸钠析出TiO(OH)2,加热煅烧得到TiO2,加入氯气、过量碳高温反应生成TiCl4和一氧化碳,四氯化钛和金属镁高温加热反应得到氯化镁和钛金属.
(1)步骤I中氧化铝与氢氧化钠反应生成偏铝酸钠与水,二氧化硅与氢氧化钠反应生成硅酸钠与水,反应离子方程式为:Al2O3+2OH-=2AlO2-+H2O、SiO2+2OH-=SiO32-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O、SiO2+2OH-=SiO32-+H2O;
(2)a.由溶度积可知,步骤II加入铁屑原因是:将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀,
故答案为:将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀;
b.溶液Ⅱ中大量含有的阳离子有 TiO2+、Fe2+、H+,
故答案为:TiO2+、Fe2+、H+;
(3)①TiO2与氯气、过量碳高温加热反应生成TiCl4和一氧化碳,反应方程式为:TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO,
故答案为:TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO;
②TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,采用真空蒸馏的方法分离得到Ti,由物质的熔沸点,可知应加热使Mg、MgCl2转化为蒸汽,而Ti不能转化为蒸汽,需加热的温度略高于1412℃即可,
故答案为:1412;
(4)由5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,可知25mL溶液中FeSO4的物质的量为5×0.02L×0.01mol/L=0.001mol,则2.850g样品中FeSO4•7H2O的质量为0.001mol×$\frac{250mL}{25mL}$×278g/mol=2.78g,故样品中FeSO4•7H2O的质量分数为$\frac{2.78g}{2.850g}$×100%=97.5%.
故答案为:97.5%.
点评 本题考查物质准备工艺流程,涉及对操作与原理的分析评价、物质的分离提纯、陌生方程式的书写、物质含量测定、对数据的运用用等,侧重考查学生的阅读获取信息、分析解决问题的能力,是对学生综合能力的考查.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 $\stackrel{+HCN}{→}$
$\stackrel{+HCN}{→}$
 .
. .
.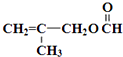
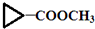
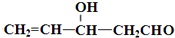
 )”的合成路线(试剂及溶剂任选;合成路线参照“已知”中的书写形式)
)”的合成路线(试剂及溶剂任选;合成路线参照“已知”中的书写形式) .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
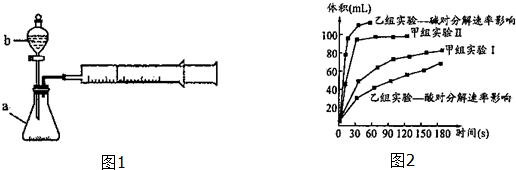
| 实验编号 | 实验目的 | t℃ | 催化剂 | 浓度 |
| 甲组实验Ⅰ | 做实验参照 | 25 | 3滴FeCl3溶液 | 10ml 2%H2O2 |
| 甲组实验Ⅱ | 探究浓度对速率的影响 | 25 | 10ml 5%H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 第一次滴定 | 第二次滴定 | 第三次滴定 | |
| 待测溶液体积(mL) | 25.00 | 25.00 | 25.00 |
| 标准溶液体积(mL) | 9.99 | 10.01 | 10.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
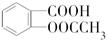 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下: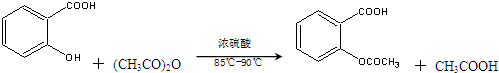
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 易水解 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
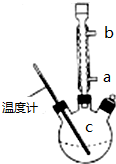
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 再滴加AgNO3溶液,观察是否有AgI沉淀产生 | |
| B. | 加入CC14振荡后,观察下层液体颜色 | |
| C. | 加入CC14振荡后,取上层清液,滴加AgNO3溶液,观察是否有AgCl沉淀产生 | |
| D. | 加入CC14振荡后,取上层清液,滴加KSCN溶液,观察是否有血红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com