
[ ]
A.甲烷和丙烯 B.乙烯和丁烯 C.乙炔和丙烯 D.乙烷和丙烯
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
 生物质资源是一种污染小的可再生能源.生物质的主要转化途径及主要产物如图.
生物质资源是一种污染小的可再生能源.生物质的主要转化途径及主要产物如图.| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO、2molH2 | 1mol CH3OH | 2molCO、4molH2 |
| CH3OH的浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
| 平衡常数 | K1 | K2 | K3 |
| 反应物转化率 | α 1 | α 2 | α 3 |

查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验序号 | 甲针筒内物质 | 乙针筒内物质 | 甲针筒的现象 |
| 1 | 10mL FeSO4溶液 | 10mL NH3 | 生成白色沉淀,后变色 |
| 2 | 15mL H2S | 10mL SO2 | 活塞自动向内移动,析出浅黄色固体 |
| 3 | 10mL Cl2 | 40mL NH3 | |
| 4 | 25mL混合气体 | 10mL H2O(l) | 剩有无色气体,活塞自动向内移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 1.容器 | 2.甲 | 3.乙 | 4.丙 |
| 5.反应物投入量 | 6.1molCO、2molH2 | 7.l molCH3OH | 8.2molCO、4molH2 |
| 9.CH30H昀浓度(mol/L) | 10.cl | 11.c2 | 12.c3 |
| 13.反应的能量变化 | 14.放出Q1kJ | 15.吸收Q2kJ | 16.放出Q3kJ |
| 17.平衡常数 | 18.Kl | 19.K2 | 20.K3 |
| 21.反应物转化率 | 22.al | 23.a2 | 24.a3 |
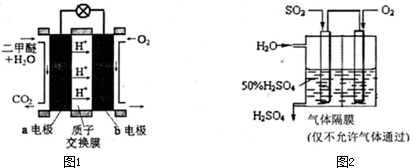
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com