

 .
.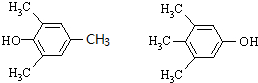 (其中一种).
(其中一种).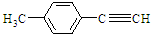 )的合成路线.
)的合成路线.分析 根据题中各物质的转化关系,B能连续发生氧化反应,B为醇,C为醛,由B的相对分子质量为60,则B为CH3CH2CH2OH,B→C发生催化氧化反应,C为CH3CH2CHO,C→D为银镜反应,则D为CH3CH2COONH4,E与氢气加成得F,根据F的结构简式可知,E为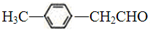 ,烃基烯基醚A的分子式为C12H16O,结合B、E的结构及信息可知,A为
,烃基烯基醚A的分子式为C12H16O,结合B、E的结构及信息可知,A为 ,由E合成对甲基苯乙炔的过程实际上就是由-CH2CHO转化成-CH═CH2,最终转化成-C≡CH的过程,可以先发生-CHO的加成,再发生醇的消去反应,然后与溴发生加成引入两个溴原子,最后发生卤代烃在NaOH醇溶液中的消去反应生成C≡C键,据此解答.
,由E合成对甲基苯乙炔的过程实际上就是由-CH2CHO转化成-CH═CH2,最终转化成-C≡CH的过程,可以先发生-CHO的加成,再发生醇的消去反应,然后与溴发生加成引入两个溴原子,最后发生卤代烃在NaOH醇溶液中的消去反应生成C≡C键,据此解答.
解答 解:根据题中各物质的转化关系,B能连续发生氧化反应,B为醇,C为醛,由B的相对分子质量为60,则B为CH3CH2CH2OH,B→C发生催化氧化反应,C为CH3CH2CHO,C→D为银镜反应,则D为CH3CH2COONH4,E与氢气加成得F,根据F的结构简式可知,E为 ,烃基烯基醚A的分子式为C12H16O,结合B、E的结构及信息可知,A为
,烃基烯基醚A的分子式为C12H16O,结合B、E的结构及信息可知,A为 ,
,
(1)由上述分析可知,A为 ,
,
故答案为: ;
;
(2)C→D反应的化学方程式为:CH3CH2CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH3CH2COONH4+2Ag↓+3NH3↑+H2O,
故答案为:CH3CH2CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH3CH2COONH4+2Ag↓+3NH3↑+H2O;
(3)满足下列条件①能与FeCl3溶液发生显色反应,说明有酚羟基,②光照时与氯气反应所得的一氯取代产物不能发生消除反应,说明取代后氯原子邻位碳上没有氢原子,③分子中有4种不同化学环境的氢原子,则符合条件的F的同分异构体的结构简式为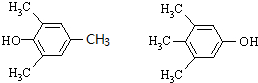 ,
,
故答案为: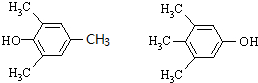 (其中一种);
(其中一种);
(4)E为 ,由E合成对甲基苯乙炔的过程实际上就是由-CH2CHO转化成-CH═CH2,最终转化成-C≡CH的过程,可以先发生-CHO的加成,再发生醇的消去反应,然后与溴发生加成引入两个溴原子,最后发生卤代烃在NaOH醇溶液中的消去反应生成C≡C键,由E合成对甲基苯乙炔(
,由E合成对甲基苯乙炔的过程实际上就是由-CH2CHO转化成-CH═CH2,最终转化成-C≡CH的过程,可以先发生-CHO的加成,再发生醇的消去反应,然后与溴发生加成引入两个溴原子,最后发生卤代烃在NaOH醇溶液中的消去反应生成C≡C键,由E合成对甲基苯乙炔( )的合成路线为:
)的合成路线为: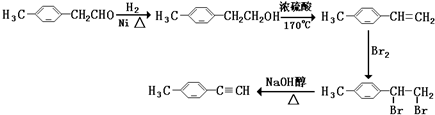 ,
,
故答案为: ;
;
点评 本题考查有机推断与合成,全面考查了有机分子式和结构简式的推导、化学方程式的书写、同分异构体的书写、有机信息的理解与应用,全面考查了学生思维能力、分析问题和解决问题的能力,难度中等.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将钠粒投入CuSO4溶液中:2Na+Cu2+=Cu+2Na+ | |
| B. | 将NaHSO4溶液滴加到含有酚酞的Ba(OH)2溶液中,溶液由红色变成无色:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| C. | 将少量醋酸加入到NaAlO2溶液中:CH3COOH+AlO2-+H2O=CH3COO-+Al(OH)3↓ | |
| D. | 硫化钠溶液中加入少量的氯化铁溶液:S2-+2Fe3+=2Fe2++S↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
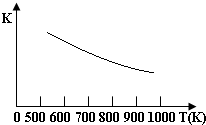 铁的氧化物可用于脱除煤气中的H2S,有一步反应为:Fe3O4(s)+3H2S(g)+H2(g)?3FeS(s)+4H2O(g)其温度与平衡常数的关系如图所示.对此反应原理的理解正确的是( )
铁的氧化物可用于脱除煤气中的H2S,有一步反应为:Fe3O4(s)+3H2S(g)+H2(g)?3FeS(s)+4H2O(g)其温度与平衡常数的关系如图所示.对此反应原理的理解正确的是( )| A. | H2S是还原剂 | B. | 脱除H2S的反应是放热反应 | ||
| C. | 温度越高H2S的脱除率越大 | D. | 压强越小H2S的脱除率越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高价含氧酸酸性:X<Y | B. | X、Y、Z可形成离子化合物 | ||
| C. | W可形成双原子分子 | D. | M与W形成的化合物含极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | CH2=CH2通入溴的四氯化碳溶液中 | 溶液褪色 | CH2=CH2发生取代反应 |
| B | KIO3溶液中加入HI溶液并加入淀粉 | 溶液变蓝色 | 氧化性:KIO3>I2 |
| C | 将盛满氯气的试管倒扣在水槽中,放在日光下静置一段时间 | 气体逐渐减少,最后变为无色 | Cl2置换出水中的氧生成了O2 |
| D | 将苯、溴水混合后加入大试管加热 | 试管底部产生油状物 | 苯发生取代反应生成溴苯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
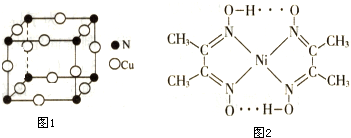
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
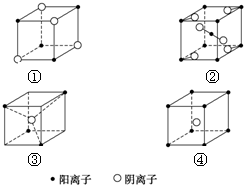
| A. | ①MN ②MN2 ③MN2 ④MN | B. | ①MN ②MN2 ③MN3 ④MN4 | ||
| C. | ①MN2 ②MN2 ③MN2 ④MN | D. | ①MN ②MN ③MN2 ④MN2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱与醋酸反应:CO32-+2H+=H2O+CO2↑ | |
| B. | 等物质的量的SO2和Cl2通入水中:SO2+Cl2+2H2O=4H++SO42-+2Cl- | |
| C. | NH4HCO3溶液与过量的浓NaOH溶液反应:NH4++OH-=NH3↑+H2O | |
| D. | 锌与稀硝酸反应:Zn+2H+=Zn2++H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com