
| A. | 单位时间内生成n molA2同时生成n mol AB3 | |
| B. | 容器内的总物质的量不随时间变化 | |
| C. | 单位时间内生成2n mol AB3的同时生成n molB2 | |
| D. | 单位时间内生成n molA2的同时生成n molB2 |
分析 一定温度下,可逆反应A2(g)+3B2(g)?2AB3(g) 达到平衡状态,一定满足正逆反应速率相等,反应体系中各组分的浓度不再变化,据此进行判断.
解答 解:达到化学平衡状态,正逆反应速率相等,各组分的浓度不变,
A、容器内每生成nmol A2,同时生成nmol AB3,表示的是正逆反应速率,但是不满足化学计量数关系,所以正逆反应速率不相等,该反应没有达到平衡状态,故A错误;
B、该反应前后气体物质的量不同,所以容器内的总物质的量不随时间变化,表明正逆反应速率相等,各组分的浓度不再变化,达到了平衡状态,故B正确;
C、单位时间内生成2n mol AB3的同时生成n molB2,表示的是正逆反应速率,但是不满足化学计量数关系,所以正逆反应速率不相等,该反应没有达到平衡状态,故C错误;
D、单位时间内生成n molA2的同时生成n molB2,都是指逆反应速率且不满足化学计量数关系,故D错误;
故选B.
点评 本题考查了化学平衡状态的判断,题目难度不大,可以根据化学平衡状态的特征-正逆反应速率相等进行判断,要求学生积累判断化学平衡状态的方法和技巧.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
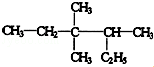 3,3,4-三甲基已烷分子结构中有1个手性碳原子.
3,3,4-三甲基已烷分子结构中有1个手性碳原子. ,
, 的分子式为C10H16,1mol该烃完全燃烧,需要标准状况下氧气313.6升.
的分子式为C10H16,1mol该烃完全燃烧,需要标准状况下氧气313.6升.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将Na2CO3固体加入新制的氯水中,有无色气泡(H+) | |
| B. | 向淀粉KI溶液中滴加新制氯水,溶液变蓝(Cl2) | |
| C. | 将AgNO3溶液滴加到新制氯水中,有白色沉淀产生(Cl-) | |
| D. | 新制氯水使红色布条褪色(HCl) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 对比实验 | 试管A | 试管B |
| 加入试剂 | 1ml0.05mol/l KMnO4 2ml0.1mol/l H2C2O4 | 1ml0.05mol/lKMnO4 2ml0.1mol/lH2C2O4 少量MnSO4 |
| (预期)实验现象 (褪色时间) | 褪色较慢 | 褪色很快 |
| 结论 | 猜想Ⅱ正确 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化银为正极,被氧化 | |
| B. | 负极发生的反应为:Zn+2OH--2e-═ZnO+H2O | |
| C. | Zn为负极,被还原 | |
| D. | 该装置中的电解质为酸性物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH≡CH | B. | CH≡CCH3 | C. | CH3C≡CCH3 | D. | CH2=C(CH3)CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
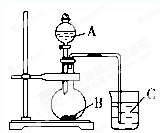 某研究性学习小组设计了一组实验验证元素周期律.非金属性越强,对应的最高价含氧酸的酸性就越强.他设计了如图装置以验证碳、氮、硅元素的非金属性强弱.已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到白色沉淀生成.
某研究性学习小组设计了一组实验验证元素周期律.非金属性越强,对应的最高价含氧酸的酸性就越强.他设计了如图装置以验证碳、氮、硅元素的非金属性强弱.已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到白色沉淀生成.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.15mol/(L•min) | B. | v(B)=0.6mol/(L•min) | ||
| C. | v(c)=0.4mol/(L•min) | D. | v(D)=0.45mol/(L•min) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com