
| A. | 把铁片与电源正极相连、碳棒与电源负极相连放入食盐水中,证明铁被保护 | |
| B. | 电解AlCl3溶液制取铝单质 | |
| C. | 用25 mL滴定管量出14.80 mL溶液 | |
| D. | 用pH试纸测得某碱溶液的pH为12.6 |
分析 A.铁片与电源正极相连,为阳极,失去电子;
B.电解AlCl3溶液,生成氢氧化铝、氢气、氯气;
C.滴定管的感量为0.01mL;
D.pH试纸测定值为正整数.
解答 解:A.铁片与电源正极相连,为阳极,失去电子,加快铁的腐蚀,故A错误;
B.电解AlCl3溶液,生成氢氧化铝、氢气、氯气,应电解熔融氧化铝冶炼Al,故B错误;
C.滴定管的感量为0.01mL,则用25 mL滴定管量出14.80 mL溶液,故C正确;
D.pH试纸测定值为正整数,则用pH试纸测得某碱溶液的pH为12或13,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握原电池、电解、仪器的使用、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | CO2、SiO2的晶体结构类型不同 | |
| B. | 加热硅、硫晶体使之熔化,克服的作用力不同 | |
| C. | HF比HCl稳定是因为HF间存在氢键 | |
| D. | NaOH、NH4Cl晶体中既有离子键又有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
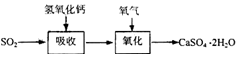
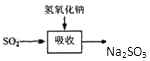
| 试剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.9 |
| 吸收SO2的成本(元/mol) | 0.027 | 0.232 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的焓变为负值 | |
| B. | 升高温度,正反应速率增大,逆反应速率减小,平衡正向移动 | |
| C. | 2CO2(g)+2H2(g)?2CO(g)+2H2O(g) 的平衡常数K1=K2 | |
| D. | 若恒容、恒温下充入CO,则K值变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | X | Y | Z | W | 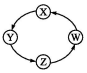 |
| ① | Cu | CuSO4 | Cu(OH)2 | CuO | |
| ② | Na | NaOH | Na2CO3 | NaCl | |
| ③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
| ④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
| A. | ①②③ | B. | ①③④ | C. | ②④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羧酸的官能团是羟基 | |
| B. | 羟基和氢氧根中含有的电子数不同 | |
| C. | 在氧气中燃烧只生成二氧化碳和水的有机物一定是烃 | |
| D. | 乙醇与钠反应生成氢气,此现象说明乙醇具有酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
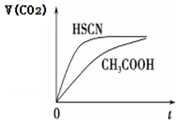 已知25℃时部分弱电解质的电离平衡常数数据如表:
已知25℃时部分弱电解质的电离平衡常数数据如表:| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.7×10-5 | 6.2×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com