
| A. | 存在两种化学键 | B. | 含共价键的离子化合物 | ||
| C. | 存在两种离子 | D. | 含共价键的共价化合物 |
 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:解答题
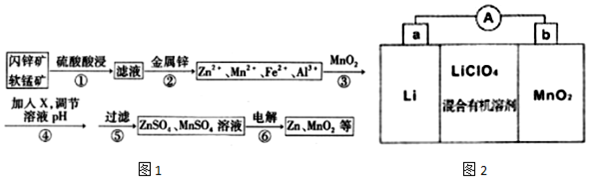
| Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
| pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2-二甲基丁烷与2,4-二甲基戊烷的一氯代物数目不相同 | |
| B. | 乙烷,苯,葡萄糖溶液均不能使酸性高锰酸钾溶液褪色 | |
| C. | 苯的密度比水小,但由苯反应制得的溴苯、硝基苯、环己烷的密度都比水大 | |
| D. | 与环己醇(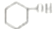 )互为同分异构体、且含有醛基(-CHO)的结构有8种(不含立体结构) )互为同分异构体、且含有醛基(-CHO)的结构有8种(不含立体结构) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含A13+总数为NA的A1C13溶液中,C1-总数为3NA | |
| B. | 标准状况下,5.6L CO2中含有的共用电子对数为0.5NA | |
| C. | Na2O2与足量的CO2反应生成0.1mol O2,转移的电子数为0.2NA | |
| D. | 常温下,56g铁片投入足量浓H2SO4中,充分反应,生成NA个SO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “真金不怕火炼”说明有些金属(例如金)即使在高温下也不与氧气发生反应 | |
| B. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| C. | 含重金属离子的电镀废液不能随意排放 | |
| D. | 铜的金属活泼性比铁弱,可在海轮外壳上装若干铜块以减缓其腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳纤维、合成纤维和光导纤维都是无机非金属材料 | |
| B. | 锅炉水垢中的硫酸钙可用碳酸钠溶液处理,使之转化为碳酸钙,再用酸除去 | |
| C. | 使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力增强 | |
| D. | 铝合金的大量使用归功于人们能使用焦炭从氧化铝中获得铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类、油脂、蛋白质在一定条件下均能水解 | |
| B. | 乙二醇、苯乙烯在一定条件下均可聚合生成高分子化合物 | |
| C. | 分子式为C4H8C12的有机物共有(不含立体异构)8种 | |
| D. | 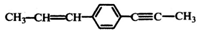 处于同一平面上的原子数最多为18个 处于同一平面上的原子数最多为18个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作设计 | 现象记录 | 结论解释 | |
| A | 醋酸加入到碳酸钠固体中,将产生的气体通入C6H5ONa 溶液中 | 溶液变浑浊 | 酸性:CH3COOH>H2CO3>C6H5OH |
| B | CH3CH2Br 与NaOH 乙醇溶液共热产生的气体通入溴水中 | 溶液褪色 | 产生了乙烯 |
| C | 向某氯化亚铁溶液中加入加入Na2O2 粉末 | 出现红褐色沉淀 | 加入 Na2O2 粉末前,原氯化亚铁溶液已经变质 |
| D | 向紫色石蕊试液中持续长时 间通人氯气 | 溶液先变红,最后变为无色 | 氯气有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
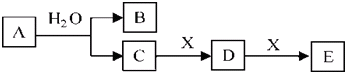
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com