
分析 (1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,核外电子排布应为1s22s22p3;
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,离子核外都有18个电子,据此计算质子数进行判断;
(3)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,应为Cu.
解答 解:(1)A元素基态原子的核外电子排布应为ns2np3,次外层有2个电子,其电子排布式为:1s22s22p3,应为N元素,其气态氢化物化学式为NH3,最高价氧化物对应的水化物为HNO3,反应的化学方程式为NH3+HNO3=NH4NO3;
故答案为:NH3+HNO3=NH4NO3;
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,离子核外都有18个电子,B元素质子数为18-1=17,B为氯元素,元素符号为Cl,其最高价氧化物的水化物的化学式为HClO4,C元素质子数为18+1=19,C为钾元素,电子排布式为1s22s22p63s23p64s1,C的最高价氧化物对应的水化物为KOH,含有的化学键为离子键、共价键;
故答案为:HClO4;1s22s22p63s23p64s1;离子键、共价键;
(3)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,基态原子的电子排布式为1s22s22p63s23p63d104s1,应为Cu元素,在周期表中的位置为第四周期IB族;
故答案为:第四周期IB族.
点评 本题考查元素推断、核外电子排布等,题目难度不大,注意掌握原子核外电子的排布规律,以此推断元素,注意基础知识的理解掌握.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | K+ Cl- MnO4- SO42- | B. | Na+ CO32- NO3- SO42- | ||
| C. | Na+ NO3- SO42- HCO3- | D. | Mg2+ SO42- S2- Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
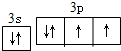 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 950 mL,76 g | B. | 500 mL,80 g | C. | 1000 mL,80 g | D. | 1000 mL,76 g |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验要求 | 选项的标号 |
| (1)证明粗盐中含有少量CaCl2 | |
| (2)鉴别Na2SO4溶液和NaCl溶液 | |
| (3)检验氯化亚铁是否变质 | |
| (4)证明某地雨水溶液呈酸性 | |
| (5)除去FeCl2溶液中的少量FeCl3 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
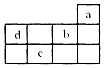
| A. | a原子最外电子层上的电子数为8 | |
| B. | b的最高价氧化物对应水化物为强酸 | |
| C. | c存在的两种常见氧化物分子组成上相差一个氧原子 | |
| D. | d和b都是第二周期的非金属元素,且d比b的非金属性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com