
| A、容器内压强不随时间的变化而变化 |
| B、容器内A、B、C、D四者共存 |
| C、A、D的消耗速率相等 |
| D、C、D的生成速率相等 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | K=1.77×10-4 | K=4.9×10-10 | K1=4.2×10-7 K2=5.6×10-11 |
| A、0.1mol?L-1NaHCO3溶液中浓度的大小:c(Na+)>c(HCO 3-)>c(H+)>c(OH-) |
| B、少量的CO2通入到NaCN溶液中 CN-+H2O+CO2=HCN+HCO 3- |
| C、用0.1mol?L-1NaOH溶液中和等浓度的HCN和HCOOH时前者所需NaOH溶液体积大 |
| D、0.1mol?L-1HCOONa溶液比0.1mol?L-1NaCN溶液所含离子总数小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
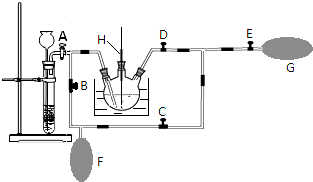 高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO2熔融氧化:3MnO2+KClO3+6KOH
高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO2熔融氧化:3MnO2+KClO3+6KOH
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeSO4在反应中作氧化剂 |
| B、随着反应的进行,该废水的pH会减小 |
| C、若该反应转移0.6mol e-,则会有0.2mol Cr2O72- 被还原 |
| D、除去废水中含铬元素离子的过程包括氧化还原反应和复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、先配制一定量的0.10mol?L-1氨水,然后测溶液的pH,若pH小于13,则可证明一水合氨为弱电解质. |
| B、先分别配制一定量0.01mol?L-1氨水和0.10mol?L-1氨水,分别用pH计测它们的pH,若两者的pH相差小于1个单位,则可证明一水合氨是弱电解质. |
| C、先测0.10mol?L-1 氨水的pH,然后将其加热至100℃,再测pH,如果pH变大则可证明一水合氨是弱电解质. |
| D、配制一定量的NH4Cl溶液.测pH.若常温下pH小于7.则证明一水合氨是弱电解质. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠投入Ca(HCO3)2溶液,反应后有白色沉淀析出 |
| B、干粉灭火器能用于扑灭金属钠、钾的着火 |
| C、生理盐水的质量分数为0.9%,与人体的血液中含量相同,它的溶质是NaCl |
| D、取用金属钠、钾时,所需实验用品有小刀、镊子、滤纸、玻璃片 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com