
【题目】沉淀的生成、溶解和转化在无机物制备和提纯以及科研等领域有广泛应用。
Ⅰ.汽车尾气中的SO2可用石灰水来吸收,生成CaSO3浊液。已知常温下Ka1(H2SO3)=1.8×10-2,Ka2(H2SO3)=6.0×10-9 常温下测得某纯CaSO3与水形成的浊液pH=9,忽略SO32-的第二步水解,则Ksp(CaSO3)=__________ 。CaSO3易变质为CaSO4,水垢中含有较多的CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。CaSO4转化为CaCO3的离子方程式为:_________;
Ⅱ.已知25℃时,NH3H2O电离常数Kb=1.8×10-5,Ksp[Mg(OH)2]=1.0×10-11,向0.4mol/L的氨水中加入等体积浓度为6×10-4mol/L MgCl2 溶液,________沉淀生成(填“无”或“有”),并简述理由______;若某溶液中C(Mg2+)=1.2×10-3mol/L,需向其中加入等体积的NaOH溶液浓度为_____ mol/L时,可使Mg2+恰好沉淀完全(忽略溶液体积变化)。
Ⅲ.工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程为:
CrO42-![]() Cr2O72-
Cr2O72-![]() Cr3+
Cr3+![]() Cr(OH)3
Cr(OH)3
其中第①步存在平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
①若平衡体系的pH=2,则溶液显____________色。
②能说明第①步反应达平衡状态的是_____________。
A.Cr2O72-和CrO42-的浓度相同 B.2v (Cr2O72-) =v (CrO42-) C.溶液的颜色不变
③第②步中,还原1mol Cr2O72-离子,需要________mol的FeSO4·7H2O。
④第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)![]() Cr3+ (aq)+3OH-(aq) 常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至__________。
Cr3+ (aq)+3OH-(aq) 常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至__________。
【答案】 4.2×10-9 CaSO4(s)+CO32-(aq)![]() CaCO3(s)+SO42-(aq) 有 因为C(OH-)=(KbC)1/2,Qc=C(Mg2+)C(OH-)2=1.08×10-9>Ksp 4.4×10-3 橙 c 6 5
CaCO3(s)+SO42-(aq) 有 因为C(OH-)=(KbC)1/2,Qc=C(Mg2+)C(OH-)2=1.08×10-9>Ksp 4.4×10-3 橙 c 6 5
【解析】Ⅰ由Ka2(H2SO3)=6.0×10-9可知SO32-+H2O![]() HSO3-+OH-的水解平衡常数
HSO3-+OH-的水解平衡常数![]() 。常温下,测得某纯CaSO3与水形成的浊液pH为9,忽略第二步水解可以得到:c(HSO3-)=c(OH-)=1×10-5mol/L,可知
。常温下,测得某纯CaSO3与水形成的浊液pH为9,忽略第二步水解可以得到:c(HSO3-)=c(OH-)=1×10-5mol/L,可知 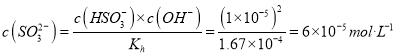 。又c(Ca2+)=c(SO32-)+c(HSO3-)=7×10-5 mol/L,所以Ksp(CaSO3)=c(Ca2+)×c(SO32-)=7×10-5×6×10-5=4.2×10-9。碳酸钙比硫酸钙更难溶,可以通过增大碳酸根浓度的方法将硫酸钙转化为碳酸钙,反应为:CaSO4(s)+CO
。又c(Ca2+)=c(SO32-)+c(HSO3-)=7×10-5 mol/L,所以Ksp(CaSO3)=c(Ca2+)×c(SO32-)=7×10-5×6×10-5=4.2×10-9。碳酸钙比硫酸钙更难溶,可以通过增大碳酸根浓度的方法将硫酸钙转化为碳酸钙,反应为:CaSO4(s)+CO![]() (aq)
(aq)![]() CaCO3(s)+SO
CaCO3(s)+SO![]() (aq)。
(aq)。
Ⅱ、氨水存在电离平衡:NH3·H2O![]() NH4+ + OH,忽略水电离,认为铵根离子浓度等于氢氧根离子浓度,考虑电离的氨水很少,所以NH3·H2O的浓度近似就是0.2mol/L(注意溶液体积是原来2倍,各自浓度都是一半)。根据平衡常数可以计算c(OH-)=
NH4+ + OH,忽略水电离,认为铵根离子浓度等于氢氧根离子浓度,考虑电离的氨水很少,所以NH3·H2O的浓度近似就是0.2mol/L(注意溶液体积是原来2倍,各自浓度都是一半)。根据平衡常数可以计算c(OH-)=![]() 。c(Mg2+)=3×10-4mol/L,所以Qc=3×10-4×
。c(Mg2+)=3×10-4mol/L,所以Qc=3×10-4×![]() =1.08×10-9>Ksp,所以有沉淀。
=1.08×10-9>Ksp,所以有沉淀。
Ⅲ:①若平衡体系的pH=2,在酸性环境下,化学反应平衡正向移动,溶液显示橙色。
②a.Cr2O72-和CrO42-的浓度相同,没有强调不变,所以不一定平衡,故a错误;b.式中未说明反应速率是指正反应还是逆反应,无法判断是不是平衡状态,故b错误;c.溶液的颜色不变,证明各组分的浓度不随时间的变化而变化,故c正确。
③第②步中,还原1molCr2O72-离子,即得到了6mol的电子,根据氧化还原反应中的电子守恒,硫酸亚铁中的亚铁离子变为三价铁离子失去1个电子,所以需要6mol的FeSO4·7H2O。
④c(Cr3+)降至10-5mol/L, ![]() ,所以pH=5。
,所以pH=5。


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】对下列实验现象及其解释不正确的是
A. 金属钠在Cl2中燃烧产生白烟,这是因为产生的NaCl固体颗粒分散到空气中所致
B. 把烧红的铁丝放在氧气中,发出耀眼白光,产生黑色固体,这是因为该反应放热多,生成的Fe3O4为黑色
C. 单质Mg、Al与O2反应,条件不同,可能产生不同的产物
D. 镁带在空气中点燃发出耀眼光芒,并发生三个反应:2Mg+O2![]() 2MgO、3Mg+N2
2MgO、3Mg+N2![]() Mg3N2、2Mg+CO2
Mg3N2、2Mg+CO2![]() 2MgO+C(黑色),Mg常用于照明弹。在这些反应中,Mg都是作还原剂
2MgO+C(黑色),Mg常用于照明弹。在这些反应中,Mg都是作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
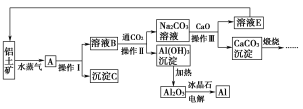
【题目】工业上用铝土矿(含氧化铝、氧化铁)制取铝的过程如下:
请回答下列问题:
(1)请说出沉淀C在工业上的一种用途:_____________________。
(2)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有_____(填化学式)。
(3)操作Ⅰ、操作Ⅱ和操作Ⅲ都是________(填操作名称)。实验室洗涤Al(OH)3沉淀的方法是__________________________________________。
(4)电解熔融的氧化铝,若得到标准状况下22.4 L O2,则同时生成铝的质量为________g。
(5)写出Na2CO3溶液与CaO反应的离子方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,浓度均为0.1 mol/L的溶液,其pH如下表所示。有关说法正确的是
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
pH | 7.0 | 7.0 | 8.1 | 8.4 |
A.酸性强弱:H2CO3>HF
B.①和②中溶质均未水解
C.离子的总浓度:①>③
D.④中:c(HCO3-) + 2c(CO32-) + c(H2CO3)![]() 0.1 mol/L
0.1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氯化铵的水溶液显弱酸性,其原因为___________________(用离子方程式表示),0.1 molL-1的氨水中加入少量的NH4Cl固体,溶液的pH________(填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度__________(填“增大”或“减小”);
(2)25℃,两种酸的电离平衡常数如下表。
化学式 | CH3COOH | H2CO3 | HCN | HClO | H2SO3 |
电离常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 5×10-10 | 3.0×10-8 | K1=2×10-2 K2=1×10-7 |
①物质的量浓度均为0.1 mol/L的四种溶液:
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH由大到小的顺序为__________(用编号填写)。
②根据上表数据判断,下列离子方程式错误的是__________。
A.CO2(过量)+H2O+ClO-=HCO3-+HClO B.SO2(过量)+H2O+ClO-=HSO3-+HClO
C.CO2(少量)+H2O+CN-=HCO3-+HCN D.SO2(少量)+H2O+CN-=HSO3-+HCN
E.SO2(少量)+2CO32-+H2O=SO32-+2HCO3- F.2SO2(过量)+CO32-+H2O=2HSO3-+CO2↑
③0.10 molL-1Na2SO3溶液中离子浓度由大到小的顺序为___________________。
④25℃时,NaCN与HCN的混合溶液,若c(CN-)=c(HCN),则溶液中pH=__________(已知lg2=0.3,lg5=0.7)。
⑤25℃时,若向NaHSO3溶液中加入少量的I2,则溶液中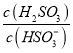 将__________(填“增大”“减小”或“不变”)。
将__________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 2.8 g环已烷含共价键数目为0.4NA
B. 过氧化钠与水反应,生成0.1 mol氧气时,转移的电子数为0.4NA
C. 142 g Na2SO4和Na2HPO4固体混合物中,阴阳离子总数为3NA
D. 用惰性电极电解CuSO4溶液后,如果加入0.1 molCu(OH)2能使溶液复原,则电路中转移电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国首个空间实验室——“天宫一号”的供电系统中,有再生氢氧燃料电池(RFC),工作原理如下图所示,a、b、c、d均为Pt电极。

下列说法正确的是
A. B区的OH通过隔膜向a电极移动,A区pH增大
B. c是正极,电极上的电极反应为:2H++2e![]() H2↑
H2↑
C. 图中右管中的OH通过隔膜向c电极移动,d电极上发生氧化反应
D. 当有1 mol电子转移时,标准状况下,b电极理论上产生气体Y的体积为11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验(已知: NH4++OH-![]() NH3↑+ H2O):
NH3↑+ H2O):
(1)第一份加入AgNO3溶液有沉淀产生;(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol;(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。根据上述实验,以下推测正确的是( )
A. K+一定存在,且100mL溶液中n(K+)≥0.02 mol
B. 100mL溶液中含0.01mol CO32-
C. Cl-一定存在
D. Ba2+一定不存在,Mg2+可能存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五氧化二钒(V2O5,摩尔质量为182g·mol-1)可作化学工业中的催化剂,广泛用于冶金、化工等行业。V2O5是一种橙黄色片状晶体,微溶于水,不溶于乙醇,具有强氧化性,属于两性氧化物。某研究小组将从某粗钒(主要含有V2O5,还有少量Al2O3、Fe2O3)中提取V2O5。实验方案设计如下:

已知:NH4VO3是白色粉末,微溶于冷水,可溶于热水,不溶于乙醇、醚。
2NH4VO3![]() V2O5+2NH3↑+H2O
V2O5+2NH3↑+H2O
请回答:
(1)第①步操作的实验装置如右图所示,虚线框中最为合适的仪器是________。(填编号)
![]()
![]()
![]()
![]()

(2)调节pH为8~8.5的目的________。
(3)第④步洗涤操作时,可选用的洗涤剂_________。(填编号)
A.冷水 B.热水 C.乙醇 D.1%NH4Cl溶液
(4)第⑤步操作时,需在流动空气中灼烧的可能原因________。
(5)硫酸工业中,SO2转化为SO3的催化剂就选用V2O5,催化过程经两步完成,将其补充完整:________(用化学方程式表示),4VO2+O2=2V2O5。
(6)将0.253g产品溶于强碱溶液中,加热煮沸,调节pH为8~8.5,向反应后的溶液中加入硫酸酸化的KI溶液(过量),溶液中含有V3+,滴加指示剂,用0.250mol·L-1Na2S2O3溶液滴定,达到终点消耗Na2S2O3标准溶液20.00mL,则该产品的纯度为________。(已知:I2+2Na2S2O3=Na2S4O6+2NaI)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com