
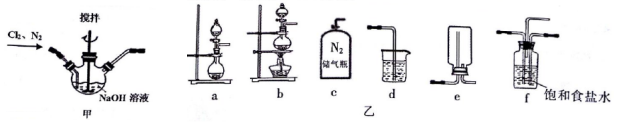
·ÖĪö £Ø1£©¢ŁĶ¼¼××°ÖĆAµÄ·“Ó¦ĪŖC12+2NaOH=NaC1+NaC1O+H2O£¬ÄĘĄė×Ó²»²ĪÓė·“Ó¦£¬Ąė×Ó·½³ĢŹ½ĪŖ£ŗC12+2OH-=C1-+C1O-+H2O£¬·ĄÖ¹ĪĀ¶Č½ĻøßÉś³ÉNaC1O3£¬ŅŖĒó·“Ó¦ĪĀ¶Č½ĻµĶ£»
¢Śøł¾Ż·“Ó¦½ųŠŠµÄĢõ¼žŗĶŗ¬ÓŠµÄŌÓÖŹŃ”Ōń³żŌÓøÉŌļ×°ÖĆ·ÖĪö£»
£Ø2£©Ė«ŃõĖ®½«ŃĒĢśĄė×ÓŃõ»ÆĪŖ»ĘÉ«µÄĢśĄė×Ó£¬Š“·½³ĢÖŖŃõ»Æ¼ĮÓė»¹Ō¼ĮÖ®±Č£»
£Ø3£©½«Fe2£ØSO4£©3ČÜŅŗ¼ÓČėµ½NaOHÓėNaC1OµÄ»ģŗĻČÜŅŗÖŠ£¬Éś³ÉNa2FeO4£¬æÉÖŖĢśŌŖĖŲ»ÆŗĻ¼ŪÉżøß±»Ńõ»Æ£¬“ĪĀČĖįÄĘŃõ»ÆĢśŌŖĖŲ£¬Ōņ“ĪĀČĖįÄʱ»»¹ŌĪŖĀČĄė×Ó£¬Š“·½³ĢŹ½£»
£Ø4£©øßĢśĖįøłŌŚĒæ¼īŠŌ½éÖŹÖŠĪČ¶Ø“ęŌŚ£¬µ«ŌŚĖįŠŌ½éÖŹÓėĖ®ÖŠĖ®½āÉś³ÉČż¼ŪĢś£¬Čż¼ŪĢśĄė×Ó¾»Ė®£¬ĖįŠŌÓŠĄūÓŚĘäĖ®½ā¾»Ė®£»
£Ø5£©øßĢśĖįÄĘŠ§¶Č»¹Ō²śÉśĢśĄė×Ó£¬ĢśĄė×ÓĖ®½āÉś³ÉĒāŃõ»ÆĢś½ŗĢå¾ßÓŠĪüø½ŠŌ£»¼ĘĖćĻąĶ¬ÖŹĮæµÄøßĢśĖįÄĘÓėĀČĘų×ŖŅʵĵē×ÓŹżæÉµĆ£®
½ā“š ½ā£ŗ£Ø1£©£©¢ŁĶ¼¼××°ÖĆAµÄ·“Ó¦ĪŖC12+2NaOH=NaC1+NaC1O+H2O£¬ÄĘĄė×Ó²»²ĪÓė·“Ó¦£¬Ąė×Ó·½³ĢŹ½ĪŖ£ŗC12+2OH-=C1-+C1O-+H2O£¬ÓÖŅŃÖŖ£ŗ3C12+6NaOH $\frac{\underline{\;\;”÷\;\;}}{\;}$5NaC1+NaC1O3+3H2O£¬·ĄÖ¹ĪĀ¶Č½ĻøßÉś³ÉNaC1O3£¬ŅŖĒó·“Ó¦ĪĀ¶Č½ĻµĶ£¬ŌņÓ¦½«¼×ÖĆÓŚĄä£Ø»ņ±ł£©Ė®Ō”ÖŠ£»
¹Ź“š°øĪŖ£ŗC12+2OH-=C1-+C1O-+H2O£»½«¼×ÖĆÓŚĄä£Ø»ņ±ł£©Ė®Ō”ÖŠ£»
¢Ś·“Ó¦ŠčŅŖ¼ÓČČ£¬¹ŹŃ”Ōńb£¬ĀČĘųÖŠ»ģÓŠĀČ»ÆĒāĘųĢ壬¹ŹÓƱ„ŗĶŹ³ŃĪĖ®³żĀČ»ÆĒā£¬ÓŠf£¬ĀČĘųÓėµŖĘų»ģŗĻŹÕ¼Æ×°ÖĆÓŠc£¬ĀČĘųĪŪČ¾»·¾³£¬Šč½ųŠŠĪüŹÕ£¬ÓŠd£»
¹Ź“š°øĪŖ£ŗbcdf£»
£Ø2£©ĻņĮņĖįĖį»ÆµÄFeSO4ČÜŅŗÖŠ¼ÓČėH2O2ČÜŅŗ£¬·¢ÉśµÄ·“Ó¦ĪŖ£ŗ2Fe2++H2O2+2H+ØT2Fe3++2H2O£¬ĢśĄė×ÓµÄČÜŅŗĻŌ»ĘÉ«£»Ė«ŃõĖ®ĪŖŃõ»Æ¼Į£¬ŃĒĢśĄė×ÓĪŖ»¹Ō¼Į£¬¹ŹŃõ»Æ¼ĮÓė»¹Ō¼ĮÖ®±ČĪŖ1£ŗ2£»
¹Ź“š°øĪŖ£ŗČÜŅŗ±ä»Ę£»1£ŗ2£»
£Ø3£©ŅŃÖŖ£ŗ£Ø3£©½«Fe2£ØSO4£©3ČÜŅŗ¼ÓČėµ½NaOHÓėNaC1OµÄ»ģŗĻČÜŅŗÖŠ£¬Éś³ÉNa2FeO4£¬æÉÖŖĢśŌŖĖŲ»ÆŗĻ¼ŪÉżøß±»Ńõ»Æ£¬“ĪĀČĖįÄĘŃõ»ÆĢśŌŖĖŲ£¬Ōņ“ĪĀČĖįÄʱ»»¹ŌĪŖĀČĄė×Ó£¬½įŗĻ¼īŠŌ»·¾³£¬·¢ÉśµÄĄė×Ó·½³ĢŹ½ĪŖ£ŗ3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O£»
¹Ź“š°øĪŖ£ŗ3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O£»
£Ø4£©øßĢśĖįøłŌŚĒæ¼īŠŌ½éÖŹÖŠĪČ¶Ø“ęŌŚ£¬µ«ŌŚĖįŠŌ½éÖŹÓėĖ®ÖŠĖ®½āÉś³ÉČż¼ŪĢśĖ®½ā¾»Ė®£¬ĖįŠŌÓŠĄūÓŚĘäĖ®½ā¾»Ė®£¬ĪŪĖ®2µÄĖįŠŌÉŌ“󣬹ŹĪŪĖ®2ÖŠøßĢśĖįÄĘÅØ¶Č½µµĶ½Ļæģ£»
¹Ź“š°øĪŖ£ŗĪŪĖ®2£»
£Ø5£©øßĢśĖįÄĘĻū¶¾»¹Ō²śÉśĢśĄė×Ó£¬ĢśĄė×ÓĖ®½āÉś³ÉĒāŃõ»ÆĢś½ŗĢå¾ßÓŠĪüø½ŠŌ£¬æɾ»Ė®£»
¼ŁÉč1moløßĢśĖįÄĘ£¬ŌņĘäÖŹĮæĪŖ166g£¬ŌņĀČĘųŅ²ĪŖ166g£¬
øł¾Ż£ŗNa2FeO4”«Fe3+”«3e-£¬ŌņøßĢśĖįÄĘ×ŖŅʵĵē×ÓŹżĪŖ3mol£¬
øł¾ŻCl2”«2Cl-”«2e-£¬
71g 2mol
166g”ś$\frac{166g”Į2mol}{71g}$=4.67mol£¬ŌņNa2FeO4 µÄĻū¶¾Š§ĀŹŹĒCl2µÄ$\frac{3mol}{4.67mol}$=0.64£»
¹Ź“š°øĪŖ£ŗøßĢśĖįÄĘĻū¶¾»¹Ō²śÉśĢśĄė×Ó£¬ĢśĄė×ÓĖ®½āÉś³ÉĒāŃõ»ÆĢś½ŗĢå¾ßÓŠĪüø½ŠŌ£»0.64£®
µćĘĄ ±¾Ģāæ¼²éĮĖĪļÖŹµÄÖʱøÓė¼ģŃ飬Éę¼°·½³ĢŹ½µÄŹéŠ“”¢ŹµŃéĢõ¼žµÄæŲÖĘ”¢¼ĘĖćµČÖŖŹ¶µć£¬ĢāÄæÄŃ¶Č½Ļ“ó£¬×¢Ņā¶ŌĢāÄæŠÅĻ¢µÄĢįČ”£®


 ³ö²ŹĶ¬²½“óŹŌ¾ķĻµĮŠ“š°ø
³ö²ŹĶ¬²½“óŹŌ¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | H2O | B£® | NH3 | C£® | PH3 | D£® | CH4 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ½šŹōļ®×÷µē³ŲµÄøŗ¼« | |
| B£® | µē³ŲÕż¼«·“Ó¦ĪŖFeS2+4Li++4e-ØTFe+2Li2S | |
| C£® | ·ÅµēŹ±£¬Li+Ļņøŗ¼«ĒØŅĘ | |
| D£® | µē³Ų×Ü·“Ó¦ĪŖFeS2+4LiØTFe+2Li2S |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÓĆpHŹŌÖ½²āµĆNaC1OČÜŅŗµÄpHĪŖ10 | |
| B£® | ÓĆ³ĪĒåŹÆ»ŅĖ®¼ų±šNa2CO3ČÜŅŗÓėNaHCO3ČÜŅŗ | |
| C£® | ĻņFe£ØNO3£©2ČÜŅŗÖŠµĪ¼ÓĻ”ŃĪĖį£¬ĪŽĆ÷ĻŌĻÖĻó | |
| D£® | ĻņK2Cr2O7ČÜŅŗÖŠµĪ¼ÓNaOHČÜŅŗ£¬ČÜŅŗÖš½„±ä»Ę |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 56gĢśŌŚ×ćĮæŃõĘųÖŠČ¼ÉÕ£¬×ŖŅʵĵē×ÓŹżĪŖ2NA | |
| B£® | 1gĒāĘųŗ¬ÓŠNAøöĒāĘų·Ö×Ó | |
| C£® | ±ź×¼×“æöĻĀ£¬22.4 LĖ®ŗ¬ÓŠ1 molĖ®·Ö×Ó | |
| D£® | 2 molÄĘÓė¹żĮæĻ”ŃĪĖį·“Ӧɜ³ÉNAøöĒāĘų·Ö×Ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÄĘŌŚĮņĖįĢśČÜŅŗÖŠæÉÖĆ»»³öĢś | B£® | ĶŌŚĻõĖįŅųČÜŅŗÖŠæÉÖĆ»»³öŅų | ||
| C£® | Ģś²»ÓėH2O·“Ó¦ | D£® | ĒāŌŚæÕĘųÖŠ»į×ŌČ¼ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĻņĀČĖ®ÖŠ¼ÓČėNaHCO3·ŪÄ©£¬ÓŠĘųÅŻ²śÉś£¬ĖµĆ÷ĀČĖ®ÖŠŗ¬ÓŠH+ | |
| B£® | µŖŌŖĖŲµÄ·Ē½šŹōŠŌĒæÓŚĮ×£¬µŖĘų»īĘĆŠŌŅ²ĒæÓŚĮ× | |
| C£® | Å©“åÓĆĆ÷·Æ¾»»ÆĖ®£¬ŹĒĄūÓĆĘäÖŠAl £ØOH£© 3½ŗĢåµÄĪüø½ŠŌ | |
| D£® | NH4FČÜŅŗ²»ÄÜ“ę·ÅÓŚ²£Į§ŹŌ¼ĮĘæÖŠ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com