
| X | ||
| Z |
| A、X位于第二周期第ⅣA族 |
| B、原子半径由小到大的顺序为:W<Z<Y |
| C、Z、W两元素的气态氢化物中,Z的气态氢化物更稳定 |
| D、无论氧气是否过量,Z在氧气中燃烧的产物唯一 |


科目:高中化学 来源: 题型:
| 分子代号 | 甲 | 乙 | 丙 | 丁 |
| 电子数 | 10 | 14 | 16 | 18 |
| A、四种气体中至少有两种气体分子互为同分异构体 |
| B、四种气体通入溴的四氯化碳溶液中,都能使其褪色 |
| C、气体丙的所有原子在同一平面上 |
| D、鉴别乙和丙两种气体,可以用酸性高锰酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CO2分子的比例模型示意图: | ||
B、质量数为40的钙原子:
| ||
C、Ca2+的结构示意图为 | ||
D、水合钠离子示意图: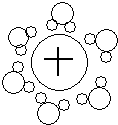 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、H+、SO42-、OH- |
| B、Na+、Ca2+、CO32-、NO3- |
| C、Na+、H+、Cl-、CO32- |
| D、Na+、Cu2+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有③ | B、①②③⑥⑧ |
| C、④⑤ | D、全部都是 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合气体的压强 |
| B、混合气体的密度 |
| C、容器内B、C、D的浓度之比为2:1:1 |
| D、混合气体的总物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com