
【题目】如图所示,容器A、B的容积相等,K为开关,活塞可以左右移动。一定温度下,关闭K,向容器A中通入一定量的NO2,发生反应2NO2(g)![]() N2O4(g)ΔH<0。则下列说法不正确的是( )
N2O4(g)ΔH<0。则下列说法不正确的是( )

A.保持活塞位置不变,打开K,体系中气体的颜色先变浅,然后略加深
B.打开K,一段时间后再关闭K,向右推动活塞,最终容器A中气体的颜色比容器B中的浅
C.保持活塞位置不变,打开K,一段时间后再关闭K,加热容器A,容器A中气体的颜色比容器B中的深
D.打开K,一段时间后再关闭K,向容器B中通入氩气,容器B中气体的颜色不变
【答案】B
【解析】
A. 保持活塞位置不变,打开K,气体的压强减小,平衡逆向移动;
B. 打开K,一段时间后A、B两端压强相等,关闭K,向右推动活塞,A中气体浓度增大,颜色变深;
C. 保持活塞位置不变,打开K,一段时间后两侧压强相等,关闭K,加热容器A,升高温度,平衡向吸热的方向移动;
D. 打开K,一段时间后再关闭K,一段时间后两侧压强相等,关闭K,向容器B中通入氩气,虽然增大压强,但反应物和生成物的浓度没有发生变化,平衡不移动。
A. 保持活塞位置不变,打开K,气体体积增大,浓度降低,颜色变浅,气体的压强减小,平衡逆向移动,气体颜色又逐渐加深,A项正确,不符合题意;
B. 打开K,一段时间后A、B两端压强相等,关闭K,向右推动活塞,A中气体浓度增大,颜色变深,虽然平衡正向移动,但颜色不会变浅,A中的颜色比B中的颜色深,B项错误,符合题意;
C. 保持活塞位置不变,打开K,一段时间后两侧压强相等,关闭K,加热容器A,升高温度,平衡向吸热的方向移动,即平衡逆向移动,A中气体颜色变深,C项正确,不符合题意;
D. 打开K,一段时间后再关闭K,一段时间后两侧压强相等,关闭K,向容器B中通入氩气,虽然增大压强,但反应物和生成物的浓度没有发生变化,平衡不移动,容器中气体的颜色不发生变化,D项正确,不符合题意;
答案选B。


科目:高中化学 来源: 题型:
【题目】如右图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的()
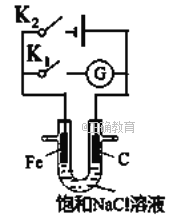
A. K1闭合,铁棒上发生的反应为2H++2e-=H2↑
B. K1闭合,石墨棒周围溶液碱性增强
C. K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D. K2闭合,电路中通过0.002NA个电子时,两极共产生0.001mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四幅图示所表示的信息与对应的叙述相符的是( )
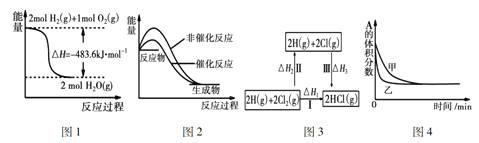
A. 图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8kJ·mol—1
B. 图2表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
C. 图3表示一定条件下H2和Cl2生成HCl的反应热与途径无关,则 △H1=△H2+△H3
D. 图4表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应mA(固)+nB(气)![]() pC(气)+qD(气),反应过程中其它条件不变时C的百分含量C%与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是
pC(气)+qD(气),反应过程中其它条件不变时C的百分含量C%与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是

A. 达到平衡后,使用催化剂,C%将增大
B. 达到平衡后,若升高温度、化学平衡向逆反应方向移动
C. 方程式中n>p+q
D. 达到平衡后,增加A的量有利于化学平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B、N、Co均为新型材料的重要组成元素。请回答下列问题。
(1)基态氮原子的价电子排布图为________________。
(2)Co能形成[Co(CNO)6]3-。
①1mol该离子中含有σ 键的数目为_____________。
②与CNO—互为等电子体的分子为_____________。(任写一种,填化学式)
(3)往CuSO4溶液中加入过量氨水,可生成[Cu(NH3)4]2+ 配离子,已知NF3和NH3的空间构型都是三角锥型,但NF3不易与Cu2+形成配合离子,其原因是_______。
(4)分子中的大 π键可用符合 πmn 表示,其中m表示形成大 π 键的原子数,n表示参与形成大 π 键的电子数(如苯分子中的大 π键可表示为π66)。则NO3-中的大 π键应表示为________________。
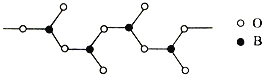
(5)多硼酸根的结构之一为链状(如图),其化学式为____________。
(6)氮化硼晶体有多种结构,其中立方氮化硼具有金刚石的结构(如图)。若晶胞边长为a nm,晶胞中N原子位于B原子所形成的正四面体的体心,则B—N键的键长为____nm,这种氮化硼晶体的密度为______g/cm3 。(用含有a和NA的代数式表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Ni、Si、P等元素)制备,回答下面问题:
(1)钴元素在元素周期表中的位置____。![]() 与硫元素位于同一主族,其价层电子排布式是___。
与硫元素位于同一主族,其价层电子排布式是___。
(2)MnSO4中阴离子的空间构型是____中心原子的杂化类型______。
(3)比较H2S ______H2Se热稳定性:(填“>”“<”)判断依据是______;比较沸点:N2H4 _____P2H4 (填“>”“<”),判断依据是______。
(4) FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子(FeCl3)2存在,画出其结构并标出配位键__________。
(5)MnO具有NaCl型结构(如图),其中阳离子采用面心立方最密堆积方式,设其晶胞参数为apm,则r(Mn2+)为______pm晶胞密度是_____g/cm3(用含a的表达式表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)高铁酸钾( K2FeO4)不仅是一种理想的水处理剂(胶体),而且高铁电池的研制也在进行中。如图1是高铁电池的模拟实验装置:

①该电池放电时正极的电极反应式为____________________________________;
②盐桥中盛有饱和KCl溶液,此盐桥中氯离子向________(填“左”或“右”)移动;若用阳离子交换膜代替盐桥,则钾离子向______(填“左”或“右”)移动。
③图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有_____________________________________________________________。
(2)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式是____________________,A是____________。

(3)利用原电池工作原理测定汽车尾气中CO的浓度,其装置如图所示。该电池中O2-可以在固体介质NASICON(固溶体)内自由移动,工作时O2-的移动方向________(填“从a到b”或“从b到a”),负极发生的电极反应式为___________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,向容积为2L的恒容密闭容器中充入一定量的CO和
时,向容积为2L的恒容密闭容器中充入一定量的CO和![]() ,发生如下反应:
,发生如下反应:![]() 。反应过程中测定的部分数据见下表:
。反应过程中测定的部分数据见下表:
反应时间 |
|
|
0 |
|
|
20 |
|
|
30 |
|
|
下列说法正确的是
A.反应在![]() 内的平均速率为
内的平均速率为![]()
B.保持其他条件不变,升高温度,平衡时![]() ,则反应的
,则反应的![]()
C.保持其他条件不变,再向平衡体系中同时通入![]() 、
、![]() 、
、![]() ,达到新平衡前
,达到新平衡前![]() 正
正![]() 逆
逆![]()
D.相同温度下,若起始时向容器中充入![]() ,达到平衡时
,达到平衡时![]() 转化率大于
转化率大于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示。下列说法错误是
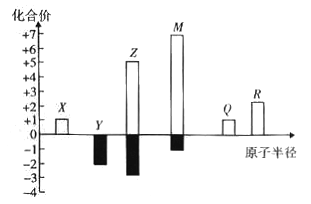
A. Q位于第三周期IA族
B. X、Y、Z三种元素组成的化合物可能是盐或碱
C. 简单离子半径:M->Q+>R2+
D. Z与M的最高价氧化物对应水化物均为强酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com