

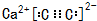 ,若晶胞的长、宽、高分别为520pm、520pm和690pm,则该晶体的密度为2.28g/cm3(精确至0.01)
,若晶胞的长、宽、高分别为520pm、520pm和690pm,则该晶体的密度为2.28g/cm3(精确至0.01) 分析 A、B、C、D、E五种元素是周期表中前四周期元素,且原子序数依次增大.其中A、B、C为同周期的非金属元素,三元素处于短周期,且B、C原子中均有两个未成对电子,二者外围电子数排布分别为ns22p2、ns22p4,结合A为非金属元素,可知A为硼元素、B为碳元素、C为O元素;D、E为同周期元素且分别位于s区和d区,则二者处于第四周期,五种元素所有的s能级电子均为全充满,则D为Ca;E的d能级电子数等于A、B、C最高能层的p能级电子数之和,则E的d能级电子数为1+2+4=7,即E的外围电子排布为3d74s2,故E为Co,
(1)非金属性越强电负性越大,同周期自左而右电负性增大;
(2)E为Fe,Fe2+离子的价电子排布式为3d6,根据泡利原理、洪特规则画出价电子排布图;,
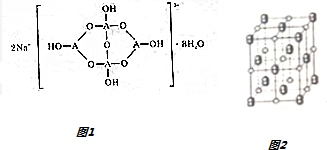
(3)①A为B原子,结构中B原子形成3个单键、4个单键(含有1个配位键),B原子核外最外层的3个电子全部参与成键;
②形成4个键的B原子中含有1个配位键,氢氧根离子中氧原子与B原子之间形成配位键;该阴离子通过氢键相互结合形成链状结构;
③H3AO3为一元弱酸,与水形成配位键,电离出[A(OH)4]-与氢离子;
(4)N元素电负性更小,更易给出孤对电子形成配位键,[Fe(NH3)6]2+的立体构型为正八面体,
(5)由元素C、Ca组成的某离子化合物为CaC2,属于离子化合物,C22-离子中碳原子之间形成3对共用电子对;
晶胞中钙离子、C22-数目相等,根据均摊法计算晶胞中钙离子、C22-数目数目,再计算晶胞质量,根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:A、B、C、D、E五种元素是周期表中前四周期元素,且原子序数依次增大.其中A、B、C为同周期的非金属元素,三元素处于短周期,且B、C原子中均有两个未成对电子,二者外围电子数排布分别为ns22p2、ns22p4,结合A为非金属元素,可知A为硼元素、B为碳元素、C为O元素;D、E为同周期元素且分别位于s区和d区,则二者处于第四周期,五种元素所有的s能级电子均为全充满,则D为Ca;E的d能级电子数等于A、B、C最高能层的p能级电子数之和,则E的d能级电子数为1+2+4=7,即E的外围电子排布为3d74s2,故E为Co,
(1)非金属性越强电负性越大,同周期自左而右电负性增大,五种元素中,O元素电负性最大,
故答案为:O;
(2)E为Co,Co2+离子的价电子排布图 ,
,
故答案为: ;
;
(3)①A为B原子,结构中B原子形成3个单键、4个单键(含有1个配位键),B原子核外最外层的3个电子全部参与成键,杂化杂化轨道类型为sp2、sp3,
故答案为:sp2、sp3;
②形成4个键的B原子中含有1个配位键,氢氧根离子中氧原子与B原子之间形成配位键,图1中用“→”标出其中的配位键为: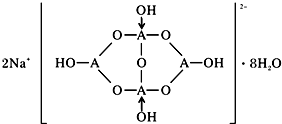 ,该阴离子通过氢键相互结合形成链状结构,
,该阴离子通过氢键相互结合形成链状结构,
故答案为: ;氢键;
;氢键;
③H3AO3为一元弱酸,与水形成配位键,电离出[A(OH)4]-与氢离子,H3BO3为一元酸的原因为:H3BO3+H2O?[B(OH)4]-+H+,
故答案为:H3BO3+H2O?[B(OH)4]-+H+;
(4)Fe2+离子在水溶液中以[Fe(H2O)6]2+形式存在,向含Fe2+离子的溶液中加入氨水,可生成更稳定的[Fe(NH3)6]2+离子,其原因是:N元素电负性更小,更易给出孤对电子形成配位键,[Fe(NH3)6]2+的立体构型为正八面体,
故答案为:N元素电负性更小,更易给出孤对电子形成配位键;正八面体;
(5)由元素C、Ca组成的某离子化合物为CaC2,该物质的电子式为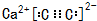 ;晶胞中钙离子、C22-数目相等,C22-数目数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则晶胞质量为4×$\frac{64}{6.02×1{0}^{23}}$g,若晶胞的长宽高分别为520pm、520pm和690pm,该晶体密度为4×$\frac{64}{6.02×1{0}^{23}}$g÷(520×10-10cm×520×10-10cm×690×10-10cm)=2.28g/cm3,故答案为:
;晶胞中钙离子、C22-数目相等,C22-数目数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则晶胞质量为4×$\frac{64}{6.02×1{0}^{23}}$g,若晶胞的长宽高分别为520pm、520pm和690pm,该晶体密度为4×$\frac{64}{6.02×1{0}^{23}}$g÷(520×10-10cm×520×10-10cm×690×10-10cm)=2.28g/cm3,故答案为: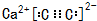 ;2.28.
;2.28.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电负性、杂化方式、微粒结构、配位键、晶胞计算等,推断元素是解题关键,侧重考查学生分析推理能力、知识迁移运用能力,需要学生具备扎实的基础.


科目:高中化学 来源: 题型:选择题
| A. | 鉴定蔗糖水解产物中有葡萄糖:在水解液中直接加入新制Cu(OH)2悬浊液 | |
| B. | 鉴别织物成分是真丝还是人造丝:灼烧 | |
| C. | 鉴定苯中有无碳碳双键:加入高锰酸钾酸性溶液 | |
| D. | 鉴别乙烯和乙烷:分别通入高锰酸钾酸性溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气与水反应:Cl2+H2O?2H++Cl-+ClO- | |
| B. | 碳酸钡溶于醋酸:BaCO3+2H+═Ba2++H2O+CO2↑ | |
| C. | 金属钠跟水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| D. | 澄清石灰中通入过量二氧化碳:Ca2++2OH-+CO2═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽车的排气管上装有“催化转化器”,使有毒的CO和NO反应生成N2和CO2 | |
| B. | 可以用澄清石灰水鉴别CO2和SO2 | |
| C. | 硫粉在过量的氧气中燃烧可以生成SO3 | |
| D. | 大量燃烧化石燃料排放的废气中含CO2、SO2,从而使雨水的pH=5.6形成酸雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X<W<Z | |
| B. | 最高价氧化物对应水化物的酸性:W>R | |
| C. | 简单气态氢化物的热稳定性:Y>W | |
| D. | Y在周期表中的位置为第二周期ⅥA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol H2完全燃烧生成气态水,放出241.8 kJ热量,H2的燃烧热△H=-241.8 kJ/mo1 | |
| B. | 在稀溶液中:H+(aq)+OH-(aq)=H2O(1)△H=-57.3kJ/mo1,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量大于57.3kJ | |
| C. | 热化学方程式中,化学式前面的化学计量数可表示微粒数,不可表示物质的量 | |
| D. | 已知:C(金刚石,s)=C(石墨,s)△H<0,因此金刚石比石墨稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4L Cl2完全溶液氢氧化钠溶液时,转移电子数为NA | |
| B. | 常温下,18g D2O中所含电子的数目为10NA | |
| C. | 标准状况下,2.24L NH3中含有的共价键数目为0.3NA | |
| D. | 常温下,23g NO2和N2O4的混合气体中含有NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO是无色气体 | B. | NO是汽车尾气的有害成分之一 | ||
| C. | 可以用向上排空气法收集NO | D. | NO在一定条件下也可做氧化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com