
【题目】已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式的叙述中,正确的是( )
A.常温下,中性溶液中,![]() 、
、![]() 、
、![]() 、
、![]() 能大量共存
能大量共存
B.向含有![]() 的溶液中通入
的溶液中通入![]() 充分反应:4Fe2++2I-+3Cl2=4Fe3++6Cl-+I2
充分反应:4Fe2++2I-+3Cl2=4Fe3++6Cl-+I2
C.向NaClO溶液中通入少量二氧化碳的离子方程式:ClO-+CO2+H2O=HClO+HCO3-
D.向![]() 溶液中滴加少量氯水,再加入
溶液中滴加少量氯水,再加入![]() 溶液振荡,静置,有机层呈橙色
溶液振荡,静置,有机层呈橙色
【答案】C
【解析】
A. Fe3+只存在于强酸性溶液中,在中性溶液中Fe3+已沉淀完全,A项错误;
B. 依据还原性强弱,I-优先反应,其次才是Fe2+。依据离子方程式2I-+Cl2=I2+2Cl-,溶液中0.8molI-完全反应需消耗0.4molCl2,而现在只通入0.3mol,所以Fe2+没有参与反应,离子反应方程式为:2I-+Cl2=I2+2Cl-,B项错误;
C. 从题给信息可知次氯酸的酸性大于HCO3-,所以向NaClO溶液中通入少量二氧化碳的离子方程式:ClO-+CO2+H2O=HClO+HCO3-,注意不能生成CO32-,因为HClO能与CO32-继续反应生成HCO3-,C项正确;
D. 氯气先与Fe2+反应,再与Br-反应。所以滴加少量的氯水,并不会生成溴单质,而是发生反应:2Fe2++Cl2=2Fe3++2Cl-,D项错误;
所以答案选择C项。


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】元素X、Y、Z为前四周期元素,X的基态原子核外电子有21种运动状态,元素Y的原子最外层电子数是其内层的3倍,Z与X、Y不在同一周期,且Z原子核外p电子比s电子多5个。
(1)X基态原子的核外电子排布式为______。
(2)X是石油化工中重要的催化剂之一,如催化异丙苯(![]() )裂化生成苯和丙烯。
)裂化生成苯和丙烯。
①1 mol异丙苯分子中含有σ键的数目为________mol。
②异丙苯分子中碳原子轨道的杂化类型为________。
(3)与Y3分子互为等电子体的阴离子为________。
(4)XZ3易溶于水,熔融状态下能够导电,据此可判断XZ3晶体属于________(填晶体类型)。
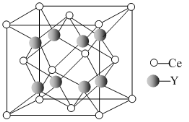
(5)元素Ce与Y形成的化合物晶体的晶胞结构如下图,该化合物的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家一直致力于“人工固氮”的研究,现已有多种方法。
(方法一)1918年,德国化学家哈伯因发明工业合成氨(N2(g)+3H2(g)![]() 2NH3(g) H<0)的方法而荣获诺贝尔化学奖。
2NH3(g) H<0)的方法而荣获诺贝尔化学奖。
(1)若将1molN2和3molH2放入1L的密闭容器中,5min后N2的浓度为0.8mol/L,这段时间内用N2的浓度变化表示的反应速率为_____mol/(L·min)。
(2)在一定温度下的定容密闭容器中发生上述反应,下列叙述能说明反应已经达到平衡状态的是____。
a. v(N2)正=3v(H2)逆
b. 容器中气体的密度不随时间而变化
c. 容器中气体的分子总数不随时间而变化
d. 容器中气体的平均相对分子质量不随时间而变化
(3)合成氨反应的生产条件选择中,能用勒夏特列原理解释的是________。
①使用催化剂 ②高温 ③高压 ④及时将氨气液化从体系中分离出来
A. ①③ B. ②③ C. ③④ D. ②④
(方法二)1998年,两位希腊化学家提出了电解合成氨的新思路:
(4)采用高质子导电性的SCY陶瓷(能传递H+)为介质,实现了高温(570℃)常压下高转化率的电解法合成氨,转化率可达到78%,装置如下图:
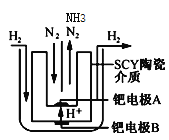
钯电极A是电解池的___极(填“阳”或“阴”),阳极反应式为________。
(方法三)最新的“人工固氮”研究报道:在常温、常压、光照条件下,N2在催化剂表面与水发生反应,直接生成氨气和氧气:
已知:N2(g)+3H2(g) ![]() 2NH3(g) △H=-92 kJ/mol
2NH3(g) △H=-92 kJ/mol
2H2(g)+O2(g)=2H2O(1) △H=-571.6 kJ/mol
(5)写出上述固氮反应的热化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
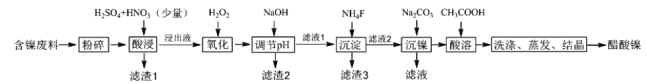
【题目】醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如图:
相关离子生成氢氧化物的pH和相关物质的溶解性如表:
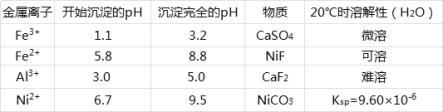
(1)酸浸过程中,1mol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的离子方程式___。
(2)滤渣1和滤渣3主要成分的化学式分别是___、____。
(3)写出氧化步骤中加入过氧化氢发生反应的离子方程式______。
(4)调节pH步骤中,溶液pH的调节范围是____。
(5)沉镍过程中,若c(Ni2+)=2.0 mol/L,欲使100mL该滤液中的Ni2+沉淀完全[c(Ni2+)<10-5mol/L],则需要加入碳酸钠固体的物质的量最少为____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想。下列说法正确的是
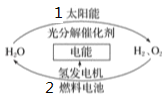
A. 过程1是放热反应
B. 过程2可将化学能转化为电能
C. 氢能源可从自然界直接获取,是一次能源
D. 氢气不易贮存和运输,无开发利用价值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
A.图甲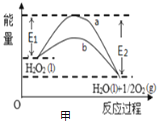 中,b曲线的热化学方程式为:H2O2(l)=H2O(l)+
中,b曲线的热化学方程式为:H2O2(l)=H2O(l)+![]() O2(g)△H=(E1-E2)kJ/mol
O2(g)△H=(E1-E2)kJ/mol
B.图乙 表示氢氟酸为弱酸,且a点
表示氢氟酸为弱酸,且a点![]() 的数值比b点
的数值比b点![]() 数值大
数值大
C.图丙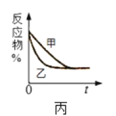 表示压强对可逆反应2A(g)+2B(g)
表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
D.图丁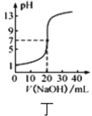 表示
表示![]() 溶液滴定
溶液滴定![]() 醋酸溶液的滴定曲线
醋酸溶液的滴定曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列属于吸热反应的是________;属于放热反应的是________。
①煅烧石灰石 ②木炭燃烧 ③酸碱中和 ④二氧化碳和碳高温反应
(2)![]() 熔点较低,易升华,溶于醇和醚,其与
熔点较低,易升华,溶于醇和醚,其与![]() 化学性质相似。由此可推断
化学性质相似。由此可推断![]() 的化学键是________(填“离子键”或“共价键”),其在固态时属于________(填“原子”、“分子”或“离子”)晶体。
的化学键是________(填“离子键”或“共价键”),其在固态时属于________(填“原子”、“分子”或“离子”)晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选择装置,完成实验。
|
|
|
|
① | ② | ③ | ④ |
(1)分离水和植物油,选用___(填序号,下同)。
(2)配制100mL0.1mol·L-1NaOH溶液,选用___。
(3)鉴别Na2CO3和NaHCO3固体,选用__。
(4)用乙酸、乙醇和浓硫酸制备乙酸乙酯,选用__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①⑤五种元素在周期表中的位置:

请按要求回答下列问题:
(1)元素④的原子结构示意图为______.
(2)元素①单质的电子式为______.
(3)元素②⑤的原子半径由大到小的顺序为(填元素符号)______,它们的最高价氧化物对应的水化物中,酸性最强的是______(填化学式).
(4)元素②的单质在氧气中燃烧的产物与二氧化碳反应的化学方程式为______;元素③的最高价氧化物与烧碱溶液反应的离子方程式为______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com