
| A. | ①④⑤⑥ | B. | ①②③⑤ | C. | ②③④⑥ | D. | 以上全部 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:①单位时间内生成n mol O2,等效于消耗2n mol NO2,同时生成2n mol NO2,正逆反应速率相等,故正确;
②混合气体的压强不再改变,说明气体的物质的量不变,反应达平衡状态,故正确;
③混合气体的平均相对分子质量不再改变,说明气体的物质的量不变,反应达平衡状态,故正确;
④单位时间内生成n mol O2,同时生成2n mol NO,都体现的正反应方向,故错误;
⑤混合气体的颜色不再改变,说明二氧化氮的浓度不变反应达平衡状态,故正确;
⑥只要反应发生就有NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1,故错误;
故选B.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


科目:高中化学 来源: 题型:选择题
| A. | 必为第1层 | B. | 只能是第2层 | C. | 只能是第3层 | D. | 可以是任意层 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 LNH3中含有的氢原子数为3NA | |
| B. | 标准状况下,足量Na2O2和11.2LCO2反应,转移电子数目为NA | |
| C. | 常温常压下,16g CH4中所含中子数为10NA | |
| D. | 常温常压下,2.8g乙烯中含有碳氢键的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | ②③⑤ | C. | ②③④⑦ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
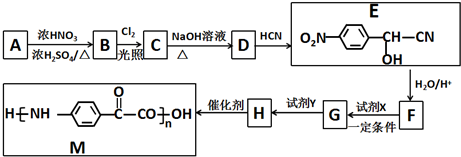
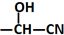 $\stackrel{H_{2}O/H+}{→}$
$\stackrel{H_{2}O/H+}{→}$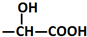
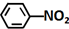 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$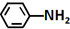 (-NH2易被氧化)
(-NH2易被氧化)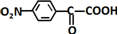 .
. .
.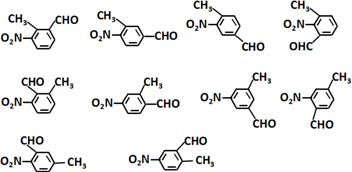
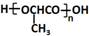 的合成路线:
的合成路线: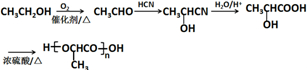 .(无机试剂任选)合成路线示例:CH≡CH$→_{催化剂/△}^{H_{2}}$CH2=CH2$→_{催化剂/△}^{HCl}$CH3CH2Cl.
.(无机试剂任选)合成路线示例:CH≡CH$→_{催化剂/△}^{H_{2}}$CH2=CH2$→_{催化剂/△}^{HCl}$CH3CH2Cl.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
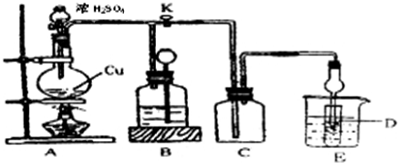
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲硫醇(CH3SH)比甲醇(CH3OH)的熔点低的原因是甲醇分子间易形成氢键 | |
| B. | N-O键的极性比C-O键的极性小 | |
| C. | 氨易液化与氨分子间存在氢键有关 | |
| D. | H2O是一种非常稳定的化合物,这是由于氢键所致 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNH3和 1molHCl混合 | |
| B. | 1mol NO和 0.5 molO2混合 | |
| C. | 1molSO2和 1 molH2S混合 | |
| D. | 等体积的NO和NO2被足量烧碱溶液吸收 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com