
����Ŀ���ڲ��������У���¯��ԭ�Ϸ�������Ҫ��ӦΪ��2Na2CO3+CaCO3+3SiO2![]() 2Na2SiO3+CaSiO3+CO2��
2Na2SiO3+CaSiO3+CO2��
��1��ij��Ӧ��������״̬�²����磬������___���塣
��2��������Ӧ�����漰�Ķ�����Ԫ��ԭ�Ӱ뾶�ɴ�С��˳��Ϊ___��
��3��̼������ͬ��Ԫ�أ�����Ԫ�ص�ԭ�����������ʾʽΪ___��
��4��дһ���ܱȽ�̼Ԫ�غ���Ԫ�طǽ�����ǿ���Ļ�ѧ��Ӧ����ʽ��___��
��5��CO2�ĵ���ʽΪ___��
��6����Ӧ��Na2CO3��CaCO3�����Ʊ�������̼�������������Ƕ���ʹ��ϡ���ᣬ��˵�����ɣ�___��
���𰸡�ԭ�� Na>Si>C>O  C+O2
C+O2 CO2
CO2 ![]() ̼�����Ƿ�ĩ״���壬��ϡ���ᷴӦ�ٶ�̫�죬���Կ��ƣ�̼�����ϡ���ᷴӦ����������ˮ������ƣ������ڷ�Ӧ�������ֹ��Ӧ�Ľ�һ������
̼�����Ƿ�ĩ״���壬��ϡ���ᷴӦ�ٶ�̫�죬���Կ��ƣ�̼�����ϡ���ᷴӦ����������ˮ������ƣ������ڷ�Ӧ�������ֹ��Ӧ�Ľ�һ������
��������
��1����Ӧ����SiO2������״̬�²����磬����ԭ�Ӿ��壻
��2���漰�Ķ�����Ԫ����Na��C��O��Si��һ����Ӳ�Խ��ԭ�Ӱ뾶Խ��ͬ���ڵ��Ӳ���ͬ��������ԭ�Ӱ뾶���μ�С������Na��C��Si��Oԭ�Ӱ뾶�ɴ�С��˳��Ϊ��Na��Si��C��O��
��3��C��SiΪ����A��Ԫ�أ�����������Ϊ4��s�ܼ�2�����ӣ�p�ܼ�2�����ӣ����������ʾʽΪ ��
��
��4���ǽ�������������Խǿ��Ԫ�طǽ�����Խǿ��C+O2 CO2����Ӧ������Ϊ��������̼Ϊ��ԭ������������������̼������֤�����ǽ�����ǿ��̼��
CO2����Ӧ������Ϊ��������̼Ϊ��ԭ������������������̼������֤�����ǽ�����ǿ��̼��
��5��CO2�ǹ��ۻ������ṹʽΪO=C=O��̼ԭ�Ӻ���ԭ��֮����2�Ե��ӣ������ʽΪ![]() ��
��
��6������������̼���Ʒ�Ӧ��ȡ������̼ԭ��̼�����Ƿ�ĩ״���壬��ϡ���ᷴӦ�ٶ�̫�죬���Կ��ƣ�����������̼��Ʒ�Ӧ��ȡ������̼ԭ��̼��������ᷴӦ�������������ḽ�������ɵIJ��ֳ������棬��ֹ��Ӧ��


 һ����ʦ�����Ծ�ϵ�д�
һ����ʦ�����Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л��ﶼ�����ڼ�Ĵ���Һ�ͼ��������·�����ȥ��Ӧ��������ͬʱ��ת������ߵ���(����)
A.![]()
B.![]()
C.![]()
D.![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ���������ʵĵ���ƽ�ⳣ�������ʾ��
��ѧʽ | CH3COOH | H2CO3 | HClO |
����ƽ�ⳣ�� | 1.7��10��5molL��1 | K1=4.4��10��7molL��1 K2=5.6��10��11molL��1 | 3.0��10��8molL��1 |
��ش��������⣺
��1��ͬŨ�ȵ�CH3COO����HCO3����CO32����ClO�����H+��������ǿ������˳��Ϊ________��
��2��������0.1molL��1��CH3COOH��Һ�ڼ�ˮϡ�����У����б���ʽ������һ����С����________������ĸ��ţ���ͬ����
A��c��H+�� B��c(H+)/c(CH3COOH) C��c��H+��c��OH���� D��c(OH-)/ c��H+�� E��c(H+)c(CH3COO-)/ c(CH3COOH)
������Һ�����¶ȣ�����5�ֱ���ʽ�������������________��
��3�����Ϊ10mL pH=2�Ĵ�����Һ��һԪ��HX��Һ�ֱ��ˮϡ����1000mL��ϡ����pH�仯��ͼ��
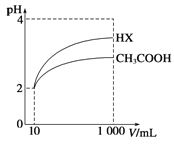
��HX�ĵ���ƽ�ⳣ��________��������������������������С�����������ƽ�ⳣ����ϡ�ͺ�HX��Һ����ˮ���������c��H+��________��������������������������С�������������Һ����ˮ���������c��H+����������____________________��
��4����֪100��ʱ��ˮ�����ӻ�Ϊ1��10��12�� ���¶��²��ij��ҺpH=7������Һ��________�����������������������������ԣ������¶���pH=1��H2SO4��ҺaL��pH=11��NaOH��ҺbL��ϣ������û��ҺpH=2����a��b=________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������A(����ʽΪC6H6O)��һ���л�����ԭ�ϡ�A���й�ת����Ӧ����(���ַ�Ӧ������ȥ)��
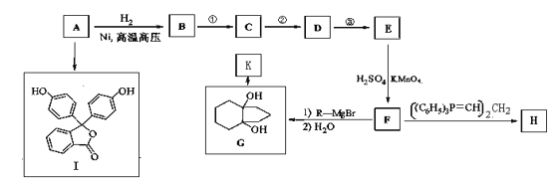
��֪����R-Br![]() R-MgBr
R-MgBr
��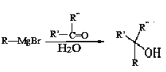
��![]() ��R��ʾ��������ԭ�ӣ�
��R��ʾ��������ԭ�ӣ�
(1)д��A�Ľṹ��ʽ��____________________________________��
(2)I�dz���ָʾ����̪��д��I�к��������ŵ�����:____________��_____________��
(3)��������Ҫ���G��ͬ���칹����________�֡�
a.G��������һ����Ԫ�� b.ֻ���������� c.G����NaHCO3��Ӧ��CO2����
(4)H��K��Ϊͬ���칹�塣д����ӦG��K�Ļ�ѧ����ʽ��________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ϡ����һ����Ҫ��ս����Դ����̼�����Ҫ��ѧ�ɷ�ΪCeFCO3��������ȡ���ϡ��Ԫ�ص���Ҫ����ԭ�ϡ���̼����ұ�������������£�
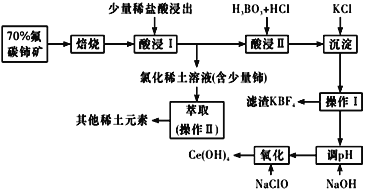
��֪����ij������ϼ�Ϊ��3����4�����պ���Ԫ��ת����CeO2��CeF4���ļ��治������Һ��������ϡ��Ԫ��������Һ��
���II�з�����Ӧ��
9CeO2��3CeF4��45HCl��3H3BO3=Ce��BF4��3����11CeCl3��6Cl2����27H2O��c��Ce3������10��5 mol/L ʱ����ȫ������
��ش��������⣺
��1���ٱ���ʱ��Ҫ����̼C����飬Ŀ���� ___________��
�ڱ��պ������CeO2������β�����������Ĺؼ��ɷ֣������ڻ�ԭ�����й����������������к�������β�����������з�����CeO2![]() CeO2��1��x����xO2����ѭ����д��CeO2����COβ���Ļ�ѧ����ʽ��________��
CeO2��1��x����xO2����ѭ����д��CeO2����COβ���Ļ�ѧ����ʽ��________��
��2�������I�����������ʱ���������������Һ���Ҳ�������ɫ���塣 ��������CeO2����ϡ����Һ������Ӧ�����ӷ���ʽ��_______��
��3����Ce��BF4��3�м���KCl��Һ��Ŀ����_________��
��4������I������Ϊ_________����ʵ�����н��в���IIʱ����Ҫ�Ĺ�����������_______��
��5��������I��������Һ�м���NaOH��Һ��������Һ��pH���Ի��Ce��OH��3�����������¼���NaOH������Һ�� pHӦ����______������ΪCe3������ȫ������{��֪��Ksp[Ce��OH��3]��1.0 ��10��20}
��6��ȡ���������еõ���Ce��OH��4��Ʒ5.00g�������ܽ�������м��뺬0.033 00 mol FeSO4��FeSO4��ҺʹCe4��ȫ������ԭ��Ce3��������0.100 0mol/L������KMnO4����Һ�ζ����յ�ʱ��ƽ������20.00 mL����Һ����ò�Ʒ��Ce��OH��4����������Ϊ______������2λС������֪�����ԣ�Ce4�� >KMnO4��Ce��OH��4 ����Է�������Ϊ208��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�����Ͽ�������C��ͨ�����з�Ӧ�ϳɣ�

�����й�������ȷ����
A.����A�DZ��״���ͬϵ��
B.����B�ܷ���ȡ�����Ӿ۵ȷ�Ӧ
C.�����Ȼ�����Һ��������C���Ƿ���CH3��CH2��17OH����
D.1 mol����C������NaOH��Һ��Ӧ����������2 mol NaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���10 mL 0.1 mol/L��HR��Һ����ε���0.l mol/L �İ�ˮ����ҺpH�������Ա仯��ͼ��

���з�����ȷ����
A.HRΪǿ��
B.����10 mL ��ˮʱ����Һ��c��NH4+����c��R����
C.c����Һ����c��NH4+����c�� R����
D.b�������Ũ�ȴ���a�������Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯����������������Ӧ�ù㷺�������죨Fe2O3������Ϊ���ϣ����ӹ�ҵ����һ��Ũ�ȵ�FeCl3��Һ��ʴ����ͭ���ľ�Ե�壬�Ƴ�ӡˢ��·�塣 aFe2��SO4�� 3��b��NH4�� 2SO4��cH2O����������泥���������������ˮ����ҵѭ��ˮ�ľ���������
��1������һ����Fe2O3��Fe3O4�Ļ������Ʒ�����n��Fe��:n��O��=1:1.375,�����Ʒ��Fe2O3�����ʵ�������Ϊ___________�����������2λ��Ч���֣�
��2��CuO��Fe2O3�Ļ����9.6 g�ڸ�������������CO��ַ�Ӧ����Ӧ��ȫ��������100mL 1.2mol/L Ba��OH��2 ��Һ���գ�����15.76 g��ɫ�������������������Һ�е����ʵĻ�ѧʽΪ__________���������CuO��Fe2O3�����ʵ���֮��Ϊ___________��
��3����ȡij���������Ʒ7.00 g����������ˮ���Ƴ�100 mL��Һ���ֳ����ȷݣ�������һ���м�������NaOH��Һ������ϴ�ӵõ�1.07 g����������һ����Һ�м��뺬0.025 molBa ��NO3��2����Һ��ǡ����ȫ��Ӧ�����������淋Ļ�ѧʽ_________��
��4���ֽ�һ�����ͭ���ľ�Ե�����800mL 3mol/L��FeCl3��Һ�У�һ��ʱ�������·��ȡ��������Һ�м�������56.0 g����ַ�Ӧ��ʣ�����51.2 g����������Һ�����ʵ����ʵ���Ũ��_________�����Է�Ӧǰ����Һ����ı仯����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ֽ�ȿɷ��ΰ�����Ⱦ�����ܵõ�����Դ���õ��㷺�о���
(1)��֪���ٷ�ӦI��4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ��H1=-1266.6 kJ��mol-1
2N2(g)+6H2O(g) ��H1=-1266.6 kJ��mol-1
��H2(g)+![]() O2(g)=H2O(l) ��H2=-285.8 kJ��mol-1
O2(g)=H2O(l) ��H2=-285.8 kJ��mol-1
��H2O(l)�TH2O(g) ��H3=+44.0 kJ��mol-1
��Ӧ2NH3(g)![]() N2(g)+3H2(g)�ķ�Ӧ����H=___��
N2(g)+3H2(g)�ķ�Ӧ����H=___��
(2)�ϳɼ״��ķ�ӦΪ��CO(g)+2H2(g)![]() CH3OH(g) ��H2����10 L�����ܱ������м���4 mol CO��8 mol H2�����CO��ƽ��ת�������¶Ⱥ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��200��ʱn(H2)��ʱ��ı仯���±���ʾ��
CH3OH(g) ��H2����10 L�����ܱ������м���4 mol CO��8 mol H2�����CO��ƽ��ת�������¶Ⱥ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��200��ʱn(H2)��ʱ��ı仯���±���ʾ��
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
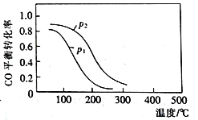
�١�H2_____(���������������)0��
������˵����ȷ����_______(���ţ���
a.�¶�Խ�ߣ��÷�Ӧ��ƽ�ⳣ��Խ��
b.��ƽ����ٳ���ϡ�����壬CO��ת�������
c.����������ѹǿ���ٱ仯ʱ����Ӧ�ﵽ�����
d.ͼ��ѹǿp1<p2
��03min����CH3OH��ʾ�ķ�Ӧ����v(CH3OH)=___(������λС��)��
��200��ʱ���÷�Ӧ��ƽ�ⳣ��K=__��������200��ﵽƽ��ĺ����ܱ��������ټ���2 mol CO��2 mol H2��2 mol CH3OH�������¶Ȳ��䣬��ѧƽ��__(�������������)�ƶ���
(3)�����ͬ�ļס������������У��ֱ��е����ʵ�����SO2��O2������ͬ�¶��·�����Ӧ��2SO2+O2![]() 2SO3�����ﵽƽ�⣬��������У�����������������䣬����������ѹǿ���䣬����������SO2��ת����Ϊp%������������SO2��ת������______________��
2SO3�����ﵽƽ�⣬��������У�����������������䣬����������ѹǿ���䣬����������SO2��ת����Ϊp%������������SO2��ת������______________��
A. ����p% B. ����p% C. С��p% D. ���ж�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com