
| A. | 用酒精萃取碘水中的碘 | |
| B. | 分液时,把上层液体从分液漏斗上口倒出 | |
| C. | 不慎洒出的少量酒精在桌上着火时,立即用湿布盖灭 | |
| D. | 配制1.00mol/LNaCl溶液时,将称好的NaCl固体放入烧杯中溶解 |
分析 A.酒精易溶于水;
B.分液时应避免液体重新混合而污染;
C.洒在桌面上的酒精燃烧起来,立即用湿抹布或沙子扑盖;
D.配制溶液时,应在烧杯中溶解,冷却后转移到容量瓶中.
解答 解:A.萃取剂与水互不相溶,而酒精易溶于水,一般用苯或四氯化碳,故A错误;
B.分液时应避免液体重新混合而污染,把上层液体从分液漏斗上口倒出,故B正确;
C.洒在桌面上的酒精燃烧起来,立即用湿抹布或沙子扑盖,可以有效的隔绝空气、灭火,故C正确;
D.容量瓶只能在常温下使用,配制溶液时,应在烧杯中溶解,冷却后转移到容量瓶中,故D正确.
故选A.
点评 本题考查较为综合,涉及萃取、事故处理和溶液配制,为高频考点,侧重学生的分析、实验能力的考查,注意把握实验的严密性、可行性的评价,题目难度不大.


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 25℃时NH4Cl溶液的Kw大于100℃时NH4Cl溶液的Kw | |
| B. | SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O═SO42-+2I- | |
| C. | 加入铝粉能产生氢气的溶液中,可能存在大量的Na+、Ba2+、AlO2-、NO3- | |
| D. | 100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
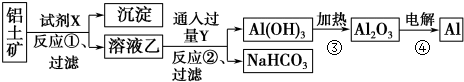
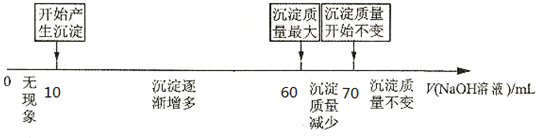
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 | |
| B. | 任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同 | |
| C. | 已知:①2H2(g)+O2(g)═2H2O(g)△H1②2H2(g)+O2(g)=2H2O(1)△H2,则△H1<△2 | |
| D. | 已知:①C(s,石墨)+O2(g)═CO2(g)△H=-393.5kJ•mol-1,②C(s,金刚石)+O2(g)═CO2(g)△H=-395.0 kJ•mol-1 则C(s,石墨)=C(s,金刚石)△H=-1.5 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 亚硫酸钠溶液加入稀硝酸:SO32-+2H+=SO2↑+H2O | |
| B. | 将1mol•L-1 NaAlO2溶液和1.5mol•L-1的HCl溶液等体积互相均匀混合:6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+ | |
| C. | 向Al2(SO4)3溶液中加入过量NH3•H2O:Al3++4NH3•H2O=[Al(OH)4]-+4NH4+ | |
| D. | 铵明矾[NH4Al(SO4)2•12H2O]溶液中加入过量Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备Fe(OH)3胶体:向0.1mol•L-1FeCl3溶液中加入等体积0.3mol•L-1NaOH溶液 | |
| B. | 除去FeCl3溶液中少量Cu2+:向含有少量Cu2+的FeCl3溶液中加入适量铁粉至蓝色刚好消失后过滤 | |
| C. | 配制1mol/LMgSO4溶液:将12.0gMgSO4固体倒进100mL容量瓶中,然后加入100mL蒸馏水 | |
| D. | 确定Na2CO3溶液中是否混有NaOH:取少量溶液滴加过量BaCl2溶液,过滤取滤液,在滤液中滴加酚酞,观察是否出现红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲、乙、丙溶液中溶质的质量分数均大于5% | |
| B. | 甲溶液中溶质的质量分数小于5%,乙、丙溶液中溶质的质量分数大于5% | |
| C. | 甲溶液中溶质的质量分数小于5%,乙的大于5%,丙的等于5% | |
| D. | 甲、乙、丙溶液中溶质的质量分数均等于5% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com