
| A.甲烷的标准燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1 |
B.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为: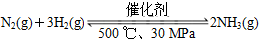 ΔH=-38.6 kJ·mol-1 ΔH=-38.6 kJ·mol-1 |
| C.活化能的作用在于使反应物活化,所以化学反应的活化能不可能接近于零或等于零 |
| D.常温下,反应C(s)+CO2(g)===2CO(g)不能自发进行,则该反应的ΔH>0 |
科目:高中化学 来源:不详 题型:单选题
| A.H2的燃烧热为241.8kJ/mol |
| B.H2(g)+1/2O2(g)=H2O(l);△H<-241.8kJ/mol |
| C.2H2(g)+O2(g)=2H2O(g);△H>-241.8kJ/mol |
| D.1molH2与1/2molO2的总能量小于1molH2O(g)的总能量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.-44.2kJ·mol-1 | B.+44.2kJ·mlo-1 | C.-330kJ·mol-1 | D.+330kJ·mlo-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 (g)+CO(g)
(g)+CO(g)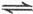 CH
CH OH(g);ΔH=-90.8 kJ·mol
OH(g);ΔH=-90.8 kJ·mol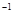
 OH(g)
OH(g)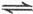 CH
CH OCH
OCH (g)+H
(g)+H O(g);ΔH=-23.5 kJ·mol
O(g);ΔH=-23.5 kJ·mol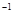
 O (g)
O (g)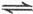 CO
CO (g)+H
(g)+H (g);ΔH=-41.3 kJ·mol
(g);ΔH=-41.3 kJ·mol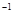
 (g)+3CO(g)
(g)+3CO(g)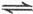 CH
CH OCH
OCH (g)+CO
(g)+CO (g)的ΔH=__________:
(g)的ΔH=__________: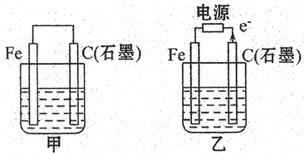
 移向__________电极(填Fe或C);
移向__________电极(填Fe或C); 氧化了生成的I
氧化了生成的I 。若反应中Cl
。若反应中Cl 和I
和I 的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为:_____________________;
的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为:_____________________;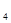 溶液。
溶液。 溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入_________(填写物质的化学式)_________g。
溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入_________(填写物质的化学式)_________g。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1 :1 | B.2 :1 | C.2 :3 | D.1 :3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.-317.3 kJ/mol | B.-379.3 kJ/mol | C.-332.8 kJ/mol | D.317.3 kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
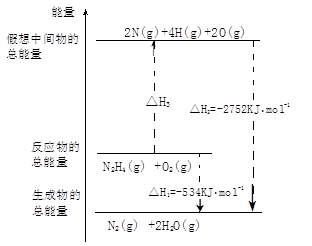
| A.194 | B.516 | C.391 | D.658 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com