
分析 ①汽化要吸热;②大多数分解反应是吸热反应;③苛性钠固体溶于水要放热;④大多数分解反应是吸热反应;⑤大多数化合反应是放热反应;⑥升华要吸热;⑦燃烧要放热;⑧中和反应是放热反应;⑨铵盐与碱反应是吸热反应.
解答 解:①液态水汽化是吸热过程,属于物理变化;
②将胆矾加热变为白色粉末是硫酸铜晶体分解失去结晶水,属于吸热反应;
③苛性钠固体溶于水溶液稳定升高,溶解过程放热,不是反应;
④氯酸钾分解制氧气是分解反应,属于吸热反应;
⑤生石灰跟水反应生成熟石灰是化合反应,属于放热反应;
⑥干冰升华固体变化为气体吸热,属于物理变化;
⑦燃烧木炭放出热量,属于放热反应;
⑧酸与碱的中和反应放出热量,属于放热反应;
⑨氢氧化钡晶体与固体氯化铵反应属于吸热反应;
故答案为:⑤⑦⑧.
点评 本题考查学生常见的放热反应和吸热反应,熟记常见的放热反应和吸热反应是解题的关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | c(H+)=c(CH3COO-)+c(OH-) | B. | c (Na+)>c (CH3COO-)>c(OH-)>c(H+) | ||
| C. | c(Na+)=c(CH3COO-)>c(OH-)=c(H+) | D. | c (CH3COO-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的气化就是将煤在高温条件由固态转化为气态的物理变化过程 | |
| B. | 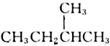 和 和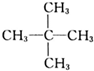 互为同分异构体 互为同分异构体 | |
| C. | 淀粉、蛋白质和油脂都是高聚物,在一定条件下都能水解 | |
| D. | 石油裂解可以得到更多的汽油,这种汽油是一种纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
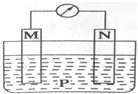 如图所示装置中,可观察到电流计指针偏转,M棒变粗,N棒变细.下表所列M、N、P物质中,可以组合成该装置的是( )
如图所示装置中,可观察到电流计指针偏转,M棒变粗,N棒变细.下表所列M、N、P物质中,可以组合成该装置的是( )| 选项号 | M | N | P |
| A | 铜 | 铁 | 稀盐酸 |
| B | 银 | 锌 | 硝酸银溶液 |
| C | 锌 | 铁 | 硝酸铁溶液 |
| D | 锌 | 铜 | 稀硫酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 构成电池的两极必须是活泼性不同的金属 | |
| B. | 锌锰干电池工作时,锌作负极 | |
| C. | 在电池中,电子流出的一极是负极,发生还原反应 | |
| D. | 铅蓄电池工作时,电子由Pb电极流出经过溶液后流向PbO2电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验方案 | 预测现象 | 预测依据 |
| 操作1:向2mL Na2CO3溶液中滴加1mL 0.5mol•L-1 CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应:Ca2++CO32-═CaCO3↓ (离子方程式) |
| 操作2:向2mL NaHCO3溶液中滴加1mL 0.5mol•L-1CaCl2溶液 | 无白色沉淀 | NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
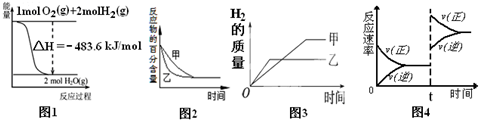
| A. | 图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ/mol | |
| B. | 图2表示压强对可逆反应2A(g)+2 B(g)?3C(g)+D(s)的影响,乙的压强比甲的压强大 | |
| C. | 图3表示等质量的钾、钠分别与足量水反应,则甲为钠 | |
| D. | 图4表示达到化学平衡后,在t时刻增加了反应物的浓度后,正逆反应速率的变化情况 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com