
分析 2-甲基丁烷为CH3CH(CH3)CH2CH3,氢原子的峰面积之比为6:1:2:3,若不同碳原子上的氢被取代的机会和速率完全相同,可知取代峰面积为6的几率最大,以此解答该题.
解答 解:2-甲基丁烷为CH3CH(CH3)CH2CH3,氢原子的峰面积之比为6:1:2:3,若不同碳原子上的氢被取代的机会和速率完全相同,可知取代峰面积为6的几率最大,生成物结构简式为CH2ClCH(CH3)CH2CH3,体积分数为$\frac{6}{6+1+2+3}×100%$=50%.
故答案为:CH2ClCH(CH3)CH2CH3;50%.
点评 本题考查有机物分子式与结构式确定,侧重于学生的分析、计算能力的考查,注意把握有机物的结构特点,有利于基础知识的巩固,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
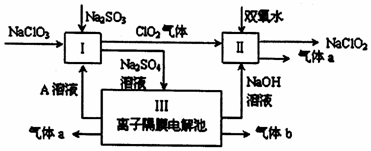
 一定温度下,将一定量的纯醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )
一定温度下,将一定量的纯醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )| A. | 醋酸的电离度:c<b<a | |
| B. | 溶液的pH值:b<a<c | |
| C. | 蘸取a点溶液滴在湿润的pH试纸上,测得pH值一定偏大 | |
| D. | 若分别取a、b、c三点的溶液各10mL,各用同浓度的氢氧化钠溶液中和,消耗NaOH溶液的体积a>b>c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用浓硫酸干燥氯气、氯化氢等气体 | |
| B. | 将KI与浓硫酸混合,有紫色蒸气产生 | |
| C. | 浓硫酸与氧化铁反应,生成硫酸铁 | |
| D. | 用浓硫酸在木制品上“烙”字画 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属铝均剩余 | |
| B. | 金属铝均溶解 | |
| C. | 盐酸中铝剩余,而氢氧化钠中铝全部溶解 | |
| D. | 氢氧化钠这铝剩余,而盐酸中铝全部溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由水电离出来的H+的浓度是1.0×10-10 mol/L | |
| B. | 该温度高于25°C | |
| C. | 加入NaHSO4晶体抑制了水的电离 | |
| D. | c(H+)=c(OH-)+c(SO42-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com