
分析 (1)配制一定物质的量浓度溶液一般步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶来分析所需的仪器;
(2)依据溶液稀释过程中溶质的物质的量不变计算需要浓硫酸体积,据此选择合适规格量筒;
(3)依据稀释过程中玻璃棒作用搅拌,移液时玻璃棒作用引流解答;
(4)根据容量瓶的构造、使用方法及配制一定物质的量浓度的溶液的正确方法分析;
(5)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)配制一定物质的量浓度溶液一般步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶,用到的仪器:量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管,用不到的仪器:烧瓶、托盘天平、药匙,故选:②④⑥;还缺少的仪器为:容量瓶,配制480mL 0.2mol•L-1的稀硫酸,应选择500mL容量瓶;
故答案为:②④⑥;500mL容量瓶;
(2)用 18.4mol•L-1的浓硫酸来配制 480mL 0.2mol•L-1的稀硫酸,应选择500mL容量瓶,实际配制500mL溶液,设需要浓硫酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:18.4mol/L×V=500mL×0.2mol/L,解得V=5.4mL,所以应选择10mL量筒;
故答案为:5.4; ①;
(3)稀释过程中玻璃棒作用搅拌,移液时玻璃棒作用引流;
故答案为:搅拌;引流;
(4)A.容量瓶的定量仪器,所以标有容积和刻度,温度影响溶液的体积,所以容量瓶上还标有使用的温度,不标有浓度,故A错误;
B.容量瓶用蒸馏水洗净后,由于后面还需要加入蒸馏水定容,所以不必烘干,不影响配制结果,故B错误;
C.容量瓶中不能用于稀释浓硫酸,应该在烧杯中稀释,冷却后转移的容量瓶中,故C错误;
D.由于容量瓶有瓶塞,配制时需要摇匀,所以使用前要检查容量瓶是否漏水,故D正确;
故选:D;
(5)①未洗涤稀释浓硫酸时用过的烧杯和玻璃棒,导致溶质部分损耗,溶质的物质量偏小,溶液浓度偏低,故①选;
②未等稀释后的硫酸溶液冷却至室温就转移到容量瓶中,冷却后,溶液体积偏小,溶液浓度偏高,故②不选;
③转移前,容量瓶中含有少量蒸馏水,对溶液体积和溶质的物质的量都不产生影响,溶液浓度不变,故③不选;
④定容时,仰视刻度线,导致溶液体积偏大,溶液浓度偏低,故④选;
故选:①④.
点评 本题考查了配制一定物质的量浓度的溶液的方法及误差分析,明确配制原理及操作步骤是解题关键,题目难度不大,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严禁的规范实验侧重能力.


科目:高中化学 来源: 题型:实验题
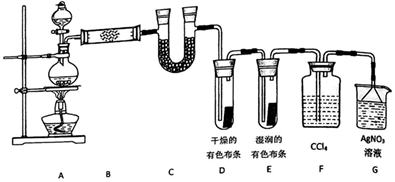
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
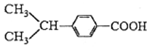 与
与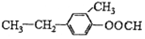
| A. | ①②③④ | B. | ①②③ | C. | ①②④ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2溶于水生成的H2SiO3的酸性弱于H2CO3 | |
| B. | SiO2是一种熔点小、硬度低的氧化物 | |
| C. | SiO2能和氢氧化钠溶液反应,因此保存氢氧化钠溶液不能用玻璃塞 | |
| D. | SiO2是一种酸性氧化物,所以不和任何酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②⑥⑦ | B. | 只有⑦ | C. | ④⑤⑦ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向盐酸中滴入少量偏铝酸钠溶液:AlO2-+H++H2O=Al(OH)3↓ | |
| B. | 向NaClO溶液中通入少量SO2:2ClO-+SO2+H2O═2HClO+SO32- | |
| C. | Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 用过量氨水吸收工业尾气中的SO2:2NH3•H2O+SO2═2NH4++SO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 体积为1ml、浓度均为0.10mol/L的XOH和X2CO3溶液,分别加水稀释至体积V,pH随lgV的变化情况如图所示,下列叙述中正确的是( )
体积为1ml、浓度均为0.10mol/L的XOH和X2CO3溶液,分别加水稀释至体积V,pH随lgV的变化情况如图所示,下列叙述中正确的是( )| A. | XOH是弱碱 | |
| B. | pH=10的两种溶液中的c(X+ ):XOH大于X2CO3 | |
| C. | 已知H2CO3的电离平衡常数Ka1远远大于Ka2,则Ka2约为1.0×10-10 | |
| D. | 当lgV=2时,若X2CO3溶液升高温度,溶液碱性增强,则c(HCO3-)/c(CO32- )减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com