
| ||
| ||
| ||


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
| A、c(H+)=0.1mol/L的甲酸溶液中,HCOO-和H+ 数目之和为0.1 NA |
| B、通常情况下,溴是液态,碘是固态,所以I-I键比Br-Br弱 |
| C、将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,2C(NH4+)=C(SO42-) |
D、合成顺丁橡胶(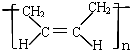 )的单体是CH2=CH-CH=CH2 )的单体是CH2=CH-CH=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
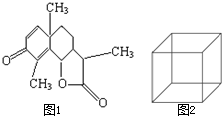 (1)图1是一种驱蛔虫药--山道年的结构简式,试确定其分子式为:
(1)图1是一种驱蛔虫药--山道年的结构简式,试确定其分子式为:查看答案和解析>>
科目:高中化学 来源: 题型:
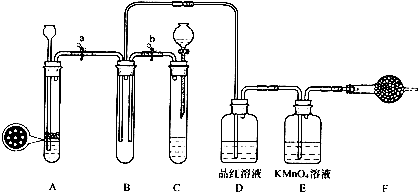
 如图所示,是一个原电池装置.它将
如图所示,是一个原电池装置.它将查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
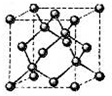 有A、B、C、D、E五种元素(A、B、C、D、E分别代表元素符号),其中A元素原子核内只有一个质子;B元素的基态原子s亚层的总电子数比p亚层的总电子数多1;C元素的原子最外层电子数是次外层电子数的3倍;D位于B的下一周期,在同周期元素形成的简单离子中,D形成的简单离子半径最小;E的基态原子中电子排布在三个能级上,且这三个能级所含电子数均相同.
有A、B、C、D、E五种元素(A、B、C、D、E分别代表元素符号),其中A元素原子核内只有一个质子;B元素的基态原子s亚层的总电子数比p亚层的总电子数多1;C元素的原子最外层电子数是次外层电子数的3倍;D位于B的下一周期,在同周期元素形成的简单离子中,D形成的简单离子半径最小;E的基态原子中电子排布在三个能级上,且这三个能级所含电子数均相同.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学药品着火,都要立即用水或泡沫灭火器灭火 |
| B、开发和推广新能源是实现低碳生活的途径之一 |
| C、食品包装袋中常放入小袋的生石灰,目的是防止食品氧化变质 |
| D、纤维素在人体内可水解为葡萄糖,故可作人类的营养物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com