
| A、熔点:F2<Cl2<Br2<I2 |
| B、微粒半径:F->Na+>Mg2+>Al3+ |
| C、酸性HClO4>H2SO4>H3PO4>H2SiO3 |
| D、热稳定性:HF<HCl<HBr<HI |


科目:高中化学 来源: 题型:
| A、2SO2(g)+O2(g)?2SO3(g) |
| B、CaCO3(s)=CaO(s)+CO2(g) |
| C、(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) |
| D、2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、S(s)的能量高于SO2(g)的能量 |
| B、S(s)和O2(g)的总能量大于SO2(g)的能量 |
| C、若有S(g)+O2(g)=SO2(g)△H2,则△H2>△H1 |
| D、形成1mol SO2(g)的化学键释放的总能量比断裂1mol S(s)和1mol O2(g)的化学键所吸收的总能量多297.23kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑤ | B、②③⑥ |
| C、①②④ | D、②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(A)=0.5mol/(L?s ) |
| B、v(C)=6.0mol/(L?min) |
| C、v(B)=0.6mol/(L?s) |
| D、v(D)=0.4mol/(L?s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C(CH3)3CH2OH |
| B、CH(CH3)2CHOHCH3 |
| C、CH3CH2CHOHCH3 |
| D、CH3CH2CHOHCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
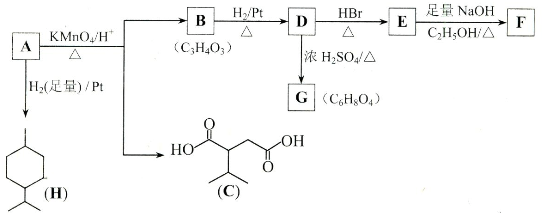
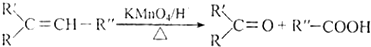
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com