
| A. | 制备无水AlCl3时,加入的SOCl2只起脱水剂作用 | |
| B. | 电池工作过程中,SOCl2被还原为Li2SO3和S单质 | |
| C. | 电池工作过程中,电子经电解质溶液流向锂电极 | |
| D. | 用该电池电解水,生成2mol H2,消耗1.5molSOCl2 |
分析 该电池的负极材料为锂,性质活泼,易与水反应,则电解质为非水溶液,根据总反应8Li+3SOCl2=6LiCl+Li2SO3+2S可知,亚硫酰氯(SOCl2)被还原为S,为正极反应,负极锂被氧化,结合电极方程式解答该题.
解答 解:A.SOCl2遇水分解成二氧化硫和氯化氢,则AlCl3•6H2O中加入SOCl2,加热时SOCl2遇水反应,既消耗水可以利用生成的HCl抑制Al3+的水解,可制得无水氯化铝,加入的SOCl2起到吸水的作用,故A错误;
B.SOCl2生成Li2SO3,S元素化合价没有发生变化,故B错误;
C.原电池工作时,电子由负极经外电路流向正极,不能经过溶液,故C错误;
D.生成2mol H2,转移4mol电子,由方程式8Li+3SOCl2═6LiCl+Li2SO3+2S可知,消耗1.5molSOCl2,故D正确.
故选D.
点评 本题考查化学电源新型电池,为高考高频点,会根据元素化合价变化确定正负极及发生的反应,难点是电极反应式的书写,知道原电池电解质溶液中阴阳离子移动方向及原因,题目难度不大.


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 最近美国科学家实施了一项“天空绿色计划”,通过电解二氧化碳得到碳材料(部分原理如图所示),并利用得到的碳材料生产锂离子电池.下列说法正确的是( )
最近美国科学家实施了一项“天空绿色计划”,通过电解二氧化碳得到碳材料(部分原理如图所示),并利用得到的碳材料生产锂离子电池.下列说法正确的是( )| A. | 图中能量化方式只有一种 | |
| B. | 阳极的电极反应式为2CO32--4e-=2CO2↑+O2↑ | |
| C. | 若反应中转移1mole-,则理论上消耗CO32-0.5mol | |
| D. | 当生成12g碳材料时,可收集到22.4L O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 明矾净水过程中不涉及化学变化 | |
| B. | 由同种元素组成的物质不一定是纯净物 | |
| C. | 风化、石油分馏和碘的升华都是物理变化 | |
| D. | 在化学反应中,反应前后原子种类、数目和质量一定不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 还原性:SO2>Fe2+>Cr3+ | B. | 氧化性:Cr2O72->SO2>Fe3+ | ||
| C. | Cr2O72-能将Na2SO3氧化成Na2SO4 | D. | 两个反应中Fe2(SO4)3均作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液的pH大于盐酸 | |
| B. | 醋酸溶液的pH小于盐酸 | |
| C. | 分别用水稀释相同倍数后,所得溶液中:c(Cl-)═c(CH3COO-) | |
| D. | 两种溶液中水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
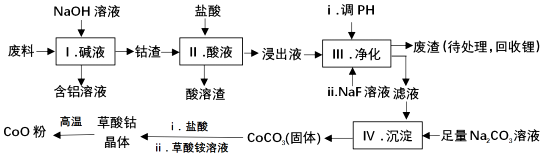
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
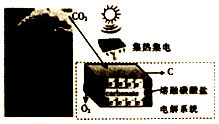
 我国科学家最近发明“可充电Na-CO2电池”,示意图如图.该电池的工作原理为:4Na+3CO2$?_{放电}^{充电}$2Na2CO3+C.下列说法错误的是( )
我国科学家最近发明“可充电Na-CO2电池”,示意图如图.该电池的工作原理为:4Na+3CO2$?_{放电}^{充电}$2Na2CO3+C.下列说法错误的是( )| A. | 放电时,Na+由钠箔端向多壁碳纳米管端移动 | |
| B. | 放电时,正极的电极反应为:3CO2+4Na++4e-═2Na2CO3+C | |
| C. | 该电池不宜在高温下使用 | |
| D. | 充电时,钠箔与外接电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com