
分析 (1)化学反应速率之比等于化学计量数之比进行计算,v(B)=3v(A)计算得到.
(2)在2L的密闭容器中,充入2mol N2和3mol H2,在一定条件下发生反应,3s后测得N2为1.9mol,氮气物质的量变化=2mol-1.9mol=0.1mol,反应的氢气物质的量=3×01mol=0.3mol,反应速率v=$\frac{△c}{△t}$;
(3)由反应速率和时间求出消耗的A的物质的量,根据变化的物质的量之比等于化学计量数之比求出生成的C的物质的量,即得到容器中C的物质的量,浓度c=$\frac{n}{V}$.
解答 解:(1)在反应A(g)+3B(g)═2C(g)中,若以物质A表示的该反应的化学反应速率为0.2mol•L-1•min-1,则以物质B表示此反应的化学反应速率为=3×0.2mol•L-1•min-1=0.6mol•L-1•min-1
故答案为:0.6;
(2)在2L的密闭容器中,充入2mol N2和3mol H2,在一定条件下发生反应,3s后测得N2为1.9mol,氮气物质的量变化=2mol-1.9mol=0.1mol,反应的氢气物质的量=3×01mol=0.3mol,则以H2的浓度变化表示的反应速率=$\frac{\frac{0.3mol}{2L}}{3s}$=0.05 mol•L-1•s-1,
故答案为:0.05 mol•L-1•s-1;
(3)在最初2s内,消耗A的平均速率为0.06mol•(L•s)-1,则消耗A的物质的量为0.06mol•(L•s)-1×10L×2s=1.2mol,变化的物质的量之比等于化学计量数之比,所以生成的C的物质的量为$\frac{2}{3}$×1.2mol=0.8 mol,浓度c=$\frac{0.8mol}{10L}$=0.08mol/L,
故答案为:0.08 mol•L-1.
点评 本题主要考查了化学反应速率的应用,题目难度不大,根据课本知识即可完成,注意变化的物质的量之比等于化学计量数之比是解题的关键.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 控制高能耗企业上马 | |
| B. | 倡导“绿色化学”理念,逐步实现化工企业零排放 | |
| C. | 加大对污染企业的整治力度 | |
| D. | 无节制地开采煤、石油、天然气等矿物资源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开启啤酒瓶后,瓶中立刻泛起大量泡沫 | |
| B. | 500℃左右比在室温时更有利于提高合成氨的转化率 | |
| C. | 硫酸工业中,将黄铁矿粉碎后加入沸腾炉中 | |
| D. | 对2HI?H2+I2平衡体系增加压强使颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
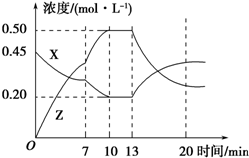
| A. | 用X表示0~10 min内该反应的平均速率为v(X)=0.045 mol•L-1•min-1 | |
| B. | 根据上图可求得化学方程式中a:b=1:3 | |
| C. | 推测在第7 min时曲线变化的原因可能是升温 | |
| D. | 推测在第13 min时曲线变化的原因可能是降温 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 氮元素及其化合物在生产、生活中有着广泛的应用.
氮元素及其化合物在生产、生活中有着广泛的应用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com