
| A. | 二氧化硫、二氧化氮和二氧化碳的任意排放都会导致酸雨 | |
| B. | Na2O可用于呼吸面具中作为氧气的来源 | |
| C. | 向煤中加入适量生石灰,可大大减少燃烧产物中SO2的量 | |
| D. | 稀双氧水可作医疗消毒剂,说明H2O2对人体无害 |
分析 A、二氧化碳能参与生态环境的循环;
B、Na2O无论是与水还是与CO2反应均不能生成氧气;
C、生石灰CaO是碱性氧化物,能和酸性氧化物反应生成盐;
D、H2O2有较强的氧化性,能引起蛋白质的变性.
解答 解:A、二氧化碳能参与生态环境的循环,不是大气污染物,不能引起酸雨,故A错误;
B、Na2O无论是与水还是与CO2反应均不能生成氧气,不能作为氧气的来源,能作为氧气来源的是过氧化钠,故B错误;
C、生石灰CaO是碱性氧化物,能和酸性氧化物反应生成盐,故生石灰能吸收燃烧产物中的SO2,减少对空气的污染,故C正确;
D、H2O2有较强的氧化性,能引起蛋白质的变性,故过量的使用也对人体有害,故D错误.
故选C.
点评 本题主要考查了过氧化氢的性质、做供氧剂的物质以及碱性氧化物的性质,属于基础性知识,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | $\frac{10}{11}$ | B. | $\frac{4}{25}$ | C. | $\frac{4}{11}$ | D. | $\frac{4}{5}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol甲基中含电子数目为7NA | |
| B. | 标准状况下,22.4L己烷中共价键数目为19NA | |
| C. | 14g乙烯和丁烯的混合物中含有的原子总数为3NA个 | |
| D. | 1mol苯乙烯(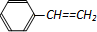 )中含有的C=C数为4NA )中含有的C=C数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
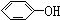 与
与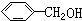
 与
与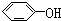
| A. | ④⑤ | B. | ①⑥ | C. | ②③ | D. | ①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇中的水(CaO、蒸馏) | B. | 溴乙烷中的乙醇(水、分液) | ||
| C. | 苯中的甲苯(Br2水、分液) | D. | 溴苯中的溴(NaOH溶液、分液) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L SO3所含的分子数目为NA | |
| B. | 0.2molH2O2催化分解,转移电子数为0.2NA | |
| C. | 0.1mol/L的100mLH2SO3溶液中,含有的离子数约为0.03NA | |
| D. | 6.25 mL1 mol/L浓硫酸与足量铜反应,转移电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ⑥ | ⑦ | ⑨ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑪ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
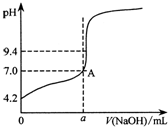 现用邻苯二甲酸氢钾(本题中用KHA表示)标准溶液来测定某NaOH溶液的浓度,进行如下操作:
现用邻苯二甲酸氢钾(本题中用KHA表示)标准溶液来测定某NaOH溶液的浓度,进行如下操作:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com