
| A、标准状况下,22.4LH2含有的分子数为NA |
| B、常温常压下,10.6gNa2C03含有的Na+数为0.1NA |
| C、通常状况下,NA个C02分子占有的体积大于22.4L |
| D、物质的量浓度为1mol/L的MgCl2溶液中,含有Cl-个数为2NA |
| m |
| M |
| m |
| M |
| 10.6g |
| 106g/mol |


科目:高中化学 来源: 题型:
| A、需要加热的化学反应都是吸热反应 |
| B、中和反应都是放热反应 |
| C、原电池是将电能转化为化学能的一种装置 |
| D、把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率减慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:
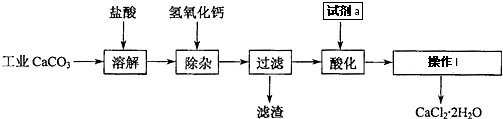
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L水所含的分子数为NA | ||||
| B、17g NH3中所含的原子个数为4NA | ||||
| C、1L、1mol/L的稀盐酸中含有的氯化氢分子数为NA | ||||
D、在反应2H2O2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水电离出的H+的浓度是1.0×10-4mol?L-1 |
| B、溶液中离子浓度:c(HSO3-)>c(SO32-)>c(H2SO3) |
| C、溶液中离子浓度:c(Na+)=c(HSO3-)+2c(SO32-)+c(H2SO3) |
| D、溶液中离子浓度:c(H+)+c(SO32-)=c(OH-)+c(H2SO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol NaCl固体溶于1 L水所得溶液中NaCl的物质的量浓度为1 mol?L-1 |
| B、2.3 g钠转化为钠离子时失去的电子数目为0.1NA |
| C、常温常压下,11.2 L H2所含的原子数目为NA |
| D、28 g氮气所含的原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、摩尔是国际上规定的七个基本物理量之一 |
| B、不同的气体,若体积不等,则它们所含的分子数一定不等 |
| C、一定温度、压强下,各种气态物质分子间距离近似相等 |
| D、气体的摩尔体积为22.4L/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
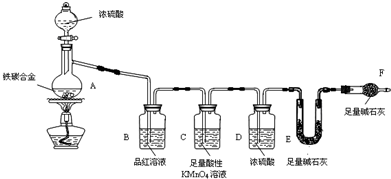
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com