
| A. | ①③⑤⑦ | B. | ②④⑥⑧ | C. | ②③⑥⑧ | D. | ②④⑤⑦ |
分析 根据影响化学平衡移动的因素:升高温度、平衡向着吸热方向移动,降低温度,平衡向着放热方向移动;增大压强,平衡向着气体体积减小的方向移动,降低压强,平衡向气体体积增大的方向移动;增大反应物浓度或者减小生成物浓度平衡都向正方向移动;催化剂只改变反应速率不改变平衡移动.
解答 解:反应A(g)+3B(g)?2C(g)(正反应为放热反应),是一个放热反应,所以升高温度,平衡逆向移动,降低温度,平衡正向移动,故①错误,②正确;增大压强,平衡向着气体体积减小的方向即正向进行,减小压强,平衡逆向移动,故③正确;④错误;加催化剂不会引起化学平衡的移动,故⑤错误;除去C,即减小生成物的浓度,平衡正向移动,故⑥正确;增加A,虽然平衡正向移动,但A的转化率仍然减小,故⑦错误;增加B,平衡正向移动,A的转化率增大,故⑧正确.
故选C.
点评 本题考查学生化学平衡移动原理知识,可以根据所学知识来回答,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | AgNO3溶液、KOH溶液、K2SO3溶液、KI溶液 | |
| B. | 苯酚溶液、CCl4溶液、氯水、氨水 | |
| C. | 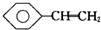 、CH3-C≡CH、福尔马林、乙醛 、CH3-C≡CH、福尔马林、乙醛 | |
| D. | NaOH溶液、FeCl2溶液、亚硫酸溶液、KCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 步骤 | 实验过程 | 实验用品 |
| Ⅰ | 将干海带灼烧灰化 |  |
| Ⅱ | 将海带灰溶解、过滤 |  和①玻璃棒(玻璃仪器名称) |
| Ⅲ | 氧化滤液中的I-,反应的离子方程式为②2I-+H2O2+2H+=I2+2H2O |  |
| Ⅳ | 取少量Ⅲ中反应后溶液于试管中,加入少量CCl4并振荡后静置,观察到③下层溶液变为紫红色,说明海带中含有碘元素. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I-的还原性比Cl-强 | B. | AgI的溶解度比AgCl的溶解度大 | ||
| C. | 氢碘酸、盐酸均为强酸 | D. | AgI比AgCl更难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 转变为
转变为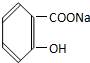 ,下列操作正确的是( )
,下列操作正确的是( )| A. | 与氢氧化钠共热后通足量的二氧化碳 | |
| B. | 溶解,加热通足量的二氧化硫气体 | |
| C. | 与稀硫酸共热后加足量氢氧化钠 | |
| D. | 与稀硫酸共热后加足量碳酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z三种短周期元素,它们的原子序数之和为16.Z元素的一种原子核内不含中子,X、Y、Z三种元素的常见单质在常温下都是无色、无味气体,在适当条件下可发生如图变化:一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10.请回答下列问题:
X、Y、Z三种短周期元素,它们的原子序数之和为16.Z元素的一种原子核内不含中子,X、Y、Z三种元素的常见单质在常温下都是无色、无味气体,在适当条件下可发生如图变化:一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10.请回答下列问题: ; C分子中所含化学键的类型是极性键,C分子的空间结构呈三角锥形.
; C分子中所含化学键的类型是极性键,C分子的空间结构呈三角锥形.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 下面给出了四种烃A、B、C、D的相关信息:
下面给出了四种烃A、B、C、D的相关信息:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,B元素名称为钾;
,B元素名称为钾;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com