
| A. | KMnO4溶液 | B. | NaClO溶液 | C. | 饱和NaHCO3溶液 | D. | 饱和Na2CO3溶液 |
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案科目:高中化学 来源: 题型:选择题
| A. | 任何可逆反应都有一定的限度 | |
| B. | 化学反应达到平衡状态时,正、逆反应速率相等 | |
| C. | 化学反应达到平衡状态与时间的长短无关 | |
| D. | 化学平衡状态是不可改变的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉中的有效成分为次氯酸钙,在空气中可以长时间放置而不变质 | |
| B. | 二氧化硅是将太阳能转变为电能的常用材料 | |
| C. | 美国纽约冬季城市供暖使用的主要能源是天然气,天然气属于不可再生能源 | |
| D. | 虎门销烟中用到了大量的生石灰,将生石灰投入销烟池的海水中,海水开始翻腾,这是一个物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
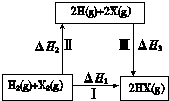
| A. | H2(g)+X2(g)=2H(g)+2X(g)△H>0 | |
| B. | 若X 分别表示Cl、Br、I,则过程Ⅱ吸收的热量依次减少 | |
| C. | 生成HX的反应热与途径有关,所以△H1≠△H2+△H3 | |
| D. | Cl2、Br2 分别发生反应Ⅰ,同一温度下的平衡常数分别为K1、K2,则K1>K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 实验操作 | 现象 | 解释或结论 |
| A | 在浓硫酸中加入过量的铁粉,充分反应后滴入KSCN溶液 | 溶液呈红色 | H2SO4将Fe氧化为Fe3+ |
| B | 将苯、溴水混合后加入大试管加热 | 试管底部产生油状物 | 苯发生了取代反应生成了溴苯 |
| C | KIO3溶液中加入HI溶液并加入淀粉 | 溶液变蓝色 | 氧化性:KIO3>I2 |
| D | Cl2通入品红溶液中 | 溶液褪色 | Cl2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 氧化物 | 环境问题 | 主要来源 |
| A | CO2 | 破坏臭氧层 | 化石燃料的燃烧 |
| B | SO2 | 温室效应 | 汽车尾气的排放 |
| C | NO2 | 光化学烟雾 | 工厂废气的排放 |
| D | CO | 酸雨 | 汽车尾气和化石燃料的不完全燃烧 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F 六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F 六种物质的转化关系如图所示(反应条件和部分产物未标出).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
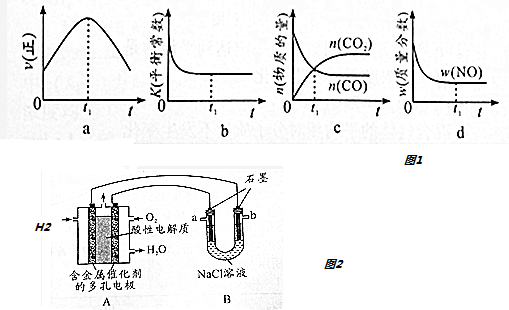
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com