
【题目】3,5二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:
甲醇、乙醚和3,5—二甲氧基苯酚的部分物理性质见下表:
物质 | 沸点/℃ | 熔点/℃ | 密度(20℃) /g·cm—3 | 溶解性 |
甲醇 | 64. 7 |
| 0. 7915 | 易溶于水 |
乙醚 | 34. 5 |
| 0. 7138 | 微溶于水 |
3,5—二甲氧基苯酚 |
| 33~36 |
| 易溶于甲醇、乙醚,微溶于水 |
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取。
①分离出甲醇的操作是。
②萃取时使用的主要仪器为。分离出该容器中的有机层的操作是。
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3 溶液洗涤的目的是。
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是(填字母)。
a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤。减压过滤完成后应先拆去连接抽气泵和吸滤瓶的橡皮管再关闭抽气泵,其目的是。
【答案】
(1)蒸馏;分液漏斗;打开瓶塞,旋转分液漏斗的活塞放出下层的水;待水放出后关闭活塞,从上口倒出有机层
(2)除去 HCl
(3)dcab
(4)为了防止倒吸
【解析】解:(1)①甲醇熔沸点较低,且易溶于水,故采用蒸馏方法,②萃取时需要用到分液漏斗;乙醚密度比水小,萃取后在上层,为了防止污染,萃取后下层溶液从下端活塞放出,上层从上口倒出;(2)反应中加人氯化氢的甲醇溶液,故有机层合有少量氯化氢,用碳酸氢钠溶液除去,然后再用饱和食盐水除去碳酸氢钠,同时使用饱和或浓无机盐溶液能减少有机物的溶解损失,(3)萃取液中合有萃取剂乙醚,产物和少量水,先用干燥剂除去水,过滤去干燥剂,再蒸馏分离出乙醚(沸点低),结晶得到产品3,5-二甲氧基苯酚;(4)为了防止倒吸,减压过滤完成后应先拆去连接抽气泵和吸滤瓶的橡皮管,切断与溶液联系。
【考点精析】本题主要考查了蒸馏与分馏的相关知识点,需要掌握蒸馏是将液态物质加热到沸腾变为蒸气,又将蒸气冷却为液体这两个过程联合操作.用这一操作可分离、除杂、提纯物质;分馏和蒸馏一样,也是利用混合物中各物质的沸点不同,严格控制温度,进行分离或提纯物质的操作,是多次的蒸馏才能正确解答此题.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】下列有关化工生产的主要设备及尾气的主要成分完全正确的是
A.炼铁—电炉—CO、CO2、N2
B.氨气—氧化炉—N2、H2
C.炼钢—转炉—Fe2O3、CO
D.硫酸—合成塔—SO2、SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是抗心律失常药物泰达隆的医药中间体,其结构简式如图所示。下列有关化合物X的说法正确的是( )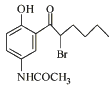
A.分子中含有1个手性碳原子
B.可以与FeCl3溶液反应生成有颜色的物质
C.在热的KOH溶液中,能发生消去反应
D.1 mol化合物X最多能与2molBr2发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】七铝十二钙 (12CaO·7Al2O3)是一种新型的超导材料和发光材料,它是用一定量的CaCO3溶解于酸性AlCl3溶液,再用氨水沉淀,然后煅烧沉淀制备。工业上制备七铝十二钙的流程如下图: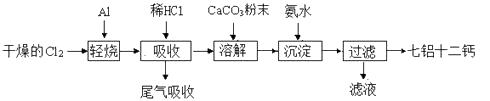
(1)轻烧后产生的AlCl3蒸气易凝华,为防止堵塞导气管可采取的措施为。
(2)吸收时用稀盐酸溶解的原因是。
(3)AlCl3溶液溶解CaCO3时,要控制碳酸钙和AlCl3的量,要求n(CaCO3)∶n(AlCl3)> 12∶14,其原因是。但若加入CaCO3过多,会产生的后果是。
(4)沉淀、过滤后的滤液主要成分是。
(5)以工业碳酸钙(含有少量Al2O3、Fe3O4杂质)生产二水合氯化钙(CaCl2·2H2O)的方法为:将工业碳酸钙溶于盐酸,加入双氧水, , 冰水洗涤,干燥,得到CaCl2·2H2O(实验中需用到的试剂和仪器有:盐酸,双氧水,氢氧化钙,冰水,pH计)。
已知:几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol/L计算):
开始沉淀的pH | 完全沉淀的pH | |
Fe3+ | 1.1 | 3.2 |
Al3+ | 3.5 | 4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素可以形成许多化合物,在我们生活生产中有广泛的应用。
(1)与NF3分子互为等电子体的分子为。
(2)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构见图甲。
①写出Fe3+的基态电子排布式。
②写出该反应的化学方程式:。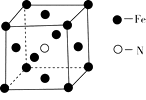
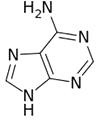
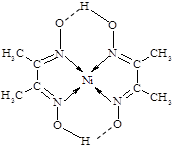
甲 乙 丙
(3)维生素B4结构如图乙,则1 mol维生素B4分子中含有σ键的数目为mol。
(4)配合物丙的结构见图,丙中含有(填序号);
a.极性共价键 b.非极性共价键 c.配位键 d.氢键
丙中碳原子的杂化方式有。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.苯酚与碳酸氢钠溶液反应:C6H5OH+HCO3﹣→C6H5O﹣+CO2↑+H2O
B.溴乙烷转化成乙醇:C2H5Br+OH﹣ ![]() C2H5OH+Br﹣
C2H5OH+Br﹣
C.肥皂液加入醋酸:C17H35COO﹣+H+→C17H35COOH
D.甲醛溶液与足量的新制Cu(OH)2共热:HCHO+2Cu(OH)2+OH﹣ ![]() HCOO﹣+Cu2O↓+3H2O
HCOO﹣+Cu2O↓+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Mg、Cu组成的2.64g混合物投入到100mL稀硝酸中完全溶解,并收集还原产物NO气体(还原产物只有一种).然后向反应后的溶液中逐滴加入2molL﹣1NaOH溶液,下图是生成沉淀的质量与滴入NaOH溶液体积间的关系图.以下说法不正确的是( ) 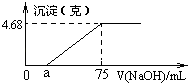
A.稀硝酸的浓度为1.9 mol/L
B.生成的NO在标况下的体积为0.896 L
C.a的值为15 mL
D.Cu的物质的量为0.02 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空
(1)有下列八种物质:Br2、I2、KI、K2SO4、KBrO2、H2SO4、KOH、H2O,它们中除一种物质外其余物质是反应物或生成物,已知Br2、I2均为产物,则反应的离子方程式为 .
(2)汽车等的安全气囊强烈碰撞时爆炸,发生的反应如后: 10NaN3+2KNO3=K2O+5Na2O+16N2↑下列判断正确的是
A.每生成8molN2转移15mol电子
B.NaN3中氮元素被还原
C.N2既是氧化剂又是还原剂
D.还原产物与氧化产物质量之比为1:15
(3)某化学兴趣小组希望能较长时间观察到白色絮状 Fe(OH)2的生成,用FeSO4(用铁粉与稀硫酸反应制得)和过量NaOH溶液反应制Fe(OH)2的装置示意图如图所示.回答下列问题: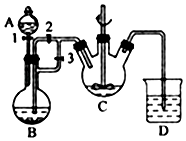
(i)A装置的名称是;在生成Fe(OH)2的装置中,发生的主要反应的离子方程式有
(ii)实验时首先打开活塞3,关闭活塞2,其目的是 .
(iii)若向制得的氢氧化亚铁的容器中通入空气,反应的化学方程式为 .
(iv)若在C中加入的是NH4HCO3时,反应时有气体产生,则最主要的离子方程式将是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com