
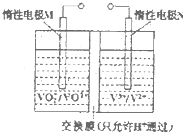
 钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域.
钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域.

科目:高中化学 来源: 题型:
| A、将等体积、等物质的量浓度的HA(HA为弱酸)与NaA混合,所得混合液的酸碱性取决于Ka(HA)的大小 | ||
| B、等物质的量的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) | ||
| C、某氨水的pH=a,某盐酸的pH=b,已知a+b=14,将上述氨水与盐酸等体积混合后,溶液中各种离子浓度的关系为:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | ||
D、CH3COOH 溶液加水稀释后,溶液中
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | 浓硝酸在光照下颜色变黄 | 浓硝酸具有不稳定性 |
| B | 浓硫酸具有酸性和脱水性 | 浓硫酸可使PH试纸先变红后变黑 |
| C | Cl2和SO2均有漂白性 | Cl2和SO2均可使含有酚酞的NaOH溶液褪色 |
| D | C的还原性小于Si | 可用焦炭和石英在高温下反应制取粗硅和CO2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
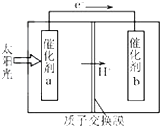 人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.如图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是( )
人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.如图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是( )| A、催化剂a附近酸性减弱,催化剂b附近酸性增强 |
| B、催化剂a表面发生氧化反应,有O2产生 |
| C、该过程是将太阳能转化为化学能的过程 |
| D、催化剂b表面的反应是CO2+2H++2e-═HCOOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将CO2通入到纯碱饱和溶液中:2Na++CO32-+CO2+H2O═2NaHCO3↓ | ||||
| B、在含有等物质的量的Fe(NO3)2和KI组成的混合溶液中滴入稀盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | ||||
| C、向Ba(OH)2溶液中加入足量的NH4HCO3溶液:Ba2++2OH-+2HCO3-═BaCO3↓+CO32-+2H2O | ||||
D、将饱和FeCl3溶液滴入沸水中制胶体:Fe3++3H2O
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com