
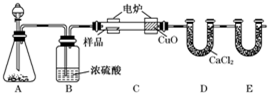
分析 本实验使用燃烧法测定有机物组成,该实验装置按照“制氧气→干燥氧气→燃烧有机物→吸收水→吸收二氧化碳”排列.实验可测知燃烧生成的二氧化碳和水的质量,根据二氧化碳的质量可求C元素的质量,由水的质量可求得H元素的质量,结合有机物的质量可求出O元素的质量,由此即可确定有机物分子中C、H、O个数比,也就是确定了实验式,若要再进一步确定有机物的分子式,还需知道该有机物的相对分子质量.
解答 解:(1)装置A是制备氧气的,所以根据装置的特点可知A装置中分液漏斗盛放的物质是双氧水或水,应该反应的化学方程式是2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑或2Na2O2+2H2O=4NaOH+O2↑,
故答案为:H2O2或(H2O);2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑或2Na2O2+2H2O=4NaOH+O2↑;
(2)由于有机物在燃烧过程中,有可能产生CO,所以C装置(燃烧管)中CuO的作用是使有机物充分氧化生成CO2和H2O,
故答案为:使有机物充分氧化生成CO2和H2O;
(3)由于有机物燃烧产生CO2,所以E装置的主要作用是吸收生成的CO2,因此其中所盛放试剂是碱石灰或氢氧化钠,
故答案为:碱石灰或氢氧化钠;吸收CO2;
(4)B装置的作用是干燥氧气,除去水蒸气,所以若将B装置去掉会造成测得有机物中含氢量增大,
故答案为:造成测得有机物中含氢量增大;
(5)D管质量增加0.72 g,则生成的水是0.72g,物质的量是0.04mol,其中氢元素的质量是0.08g,E管质量增加1.76 g,则CO2是1.76g,物质的量是0.04mol,其中碳元素的质量是0.48g,则原有机物中氧元素的质量是1.20g-0.08g-0.48g=0.64g,物质的量是0.04mol,所以原有机物中C、H、O的原子个数之比是1:2:1,则最简式是CH2O,
故答案为:CH2O;
(6)在已知最简式的情况下,要确定该化合物的化学式,则还需要测出有机物的相对分子质量,
故答案为:测出有机物的相对分子质量.
点评 本题考查根据有机物燃烧法确定有机物化学式的计算、判断以及实验操作,是中等难度的试题,试题综合性强,难易适中,贴近高考.主要是考查学生灵活运用基础知识解决实际问题的能力,有助于培养学生的逻辑推理能力和发散思维能力.该题学生需要明确的是该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1 L 0.1 mol•L-1的NH4NO3溶液中氮原子数为0.2NA | |
| B. | 标准状况下,2.24 L 已烷中含有共价键的数目为1.9NA | |
| C. | 室温下,28.0 g乙烯和丁烯的混合气体中所含碳原子数为2NA | |
| D. | 足量Fe与1 mol Cl2充分反应,转移的电子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有A、B、C、D、E五种元素,其中A元素的一种核素没有中子,B元素的电负性最大,C元素的基态原子L层上有三个未成对电子,D元素为主族元素且与E元素同周期,其最外电子层上只有两个运动状态不同的电子,E元素有两种常见氧化物E2O、EO,其中E2O为砖红色.请回答:
有A、B、C、D、E五种元素,其中A元素的一种核素没有中子,B元素的电负性最大,C元素的基态原子L层上有三个未成对电子,D元素为主族元素且与E元素同周期,其最外电子层上只有两个运动状态不同的电子,E元素有两种常见氧化物E2O、EO,其中E2O为砖红色.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
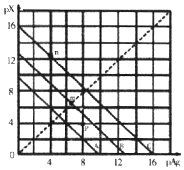 某温度时,卤化银(AgX,X=Cl,Br,I)的3条溶解平衡曲线如图所示,AgCl、AgBr、AgI的Ksp依次减小.已知pAg=-lgc(Ag+),pX=-lgc(X-),利用pX、pAg的坐标系可表示出AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系.下列说法错误的是( )
某温度时,卤化银(AgX,X=Cl,Br,I)的3条溶解平衡曲线如图所示,AgCl、AgBr、AgI的Ksp依次减小.已知pAg=-lgc(Ag+),pX=-lgc(X-),利用pX、pAg的坐标系可表示出AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系.下列说法错误的是( )| A. | A线是AgCl的溶解平衡曲线 | |
| B. | 坐标点p形成的溶液是AgCl的不饱和溶液 | |
| C. | m点是在水中加入足量的AgBr形成的饱和溶液 | |
| D. | n点表示由过量的KI与AgNO3反应产生AgI沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2在常温下是气体,SiO2在常温下是固体 | |
| B. | C、Si、Ge的最外层电子数都是4,次外层电子数都是8 | |
| C. | CO2和SiO2都是酸性氧化物,在一定条件下都能和氧化钙反应 | |
| D. | 该族元素的主要化合价是+4和+2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | 元素的相关信息 |
| M | 最高价氧化物对应水化物能与其气态氢化物反应生成盐 |
| W | 原子的M电子层上有3个电子 |
| X | 在短周期元素中,其原子半径最大 |
| Y | 最外层电子数是电子层数的2倍,且低价氧化物能与其气态氢化物反应生成Y的单质和H2O |
| Z | 元素最高正价与最低负价的代数和为6 |
| A. | M、Y、Z的简单离子半径依次增大 | |
| B. | W与Z形成的化合物属于离子化合物,其水溶液显酸性 | |
| C. | 化合物X2Y2、Y2Z2的晶体类型相同,化学键类型也相同 | |
| D. | M、W、X的最高价氧化物对应水化物两两之间能相互发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为加快漂粉精的漂白速率,使用时可滴加几滴醋酸 | |
| B. | 用作荧光灯内壁保护层的氧化铝纳米材料属于胶体 | |
| C. | “玉兔号”月球车太阳能电池帆板的材料是二氧化硅 | |
| D. | 海水中提溴的过程不涉及氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com