
������ʵ������ó��Ľ�����ȷ���ǣ�
| ���������� | ���� | |
| A | ��AgCl����Һ�м���NaI��Һʱ���ֻ�ɫ������ | Ksp��AgCl��< Ksp��AgI�� |
| B | ��ij��Һ�еμ���ˮ���ټ���KSCN��Һ����Һ�ʺ�ɫ�� | ��Һ��һ������Fe2+ |
| C | ��NaBr��Һ�е���������ˮ�ͱ��������ã���Һ�ϲ�ʳȺ�ɫ�� | Br—��ԭ��ǿ��Cl— |
| D | ����ʢ��NH4Cl������Թܣ��Թܵײ�������ʧ���Թܿ��о������ᡣ | NH4Cl����������� |
 �����ҵ���������ϵ�д�
�����ҵ���������ϵ�д� �����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д�
�����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д� �����ҵ�����������ѧ���ӳ�����ϵ�д�
�����ҵ�����������ѧ���ӳ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����Ƶ��ܱ���������м���һ���������İ�������粒���(��������������䣬��������������Բ���)���ں㶨�¶���ʹ��ﵽ�ֽ�ƽ�⣺
NH2COONH4(s)2NH3(g)��CO2(g)����֪15 ��ʱ��ƽ��������Ũ��Ϊ2.4��10��3 mol��L��1������˵������ȷ����(����)
A���ܱ������������ƽ����Է�������������÷�Ӧ�ﵽƽ��״̬
B��15 ��ʱ��������淋ķֽ�ƽ�ⳣ��Ϊ2.048��10��9
C��������ѹ�������NH3�����������С
D���ټ���һ������������泥��ɼӿ췴Ӧ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij100 mL������У�HNO3���ʵ���Ũ��Ϊ0.4 mol��L��1��H2SO4���ʵ���Ũ��Ϊ0.2 mol��L��1�������м���2.56 g Cu�ۣ�����ַ�Ӧ��(��Ӧǰ����Һ����仯���Բ���)����Һ��Cu2�����ʵ���Ũ��Ϊ(����)
A��0.15 mol��L��1 B��0.3 mol��L��1
C��0.225 mol��L��1 D��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����������£�����H2SO4��CuSO4��Һ����μ��뺬a mol���ʵ�NaOH��Һ��ǡ��ʹ��Һ��pH��7������������ȷ����(����)
A����Һ��c(Na��)��2c(SO )
)
B��0<���������ʵ���<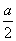 mol
mol
C�����������ʵ���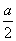 mol
mol
D��ԭ��Һ��c(H2SO4)��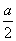 mol��L��1
mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ʯ����Ҫ�ɷ�BaCO3����Ca2+��Mg2+��Fe3+�����ʣ���ʵ�������ö���ʯ�Ʊ�BaCl2·2H2O����������:
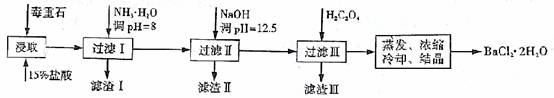
��1������ʯ�������ȡǰ������ĥ��Ŀ���� ��ʵ������37%����������15%�����ᣬ����Ͳ���ʹ�����������е� ��
a���ձ� b������ƿ c�������� d���ζ���
��2��
| Ca2+ | Mg2+ | Fe3+ | |
| ��ʼ����ʱ��pH | 11.9 | 9.1 | 1.9 |
| ��ȫ����ʱ��pH | 13.9 | 11.1 | 3.2 |
����NH3·H2O����pH=8�ɳ�ȥ �������ӷ��ţ����������к� ���ѧʽ��������H2C2O4ʱӦ���������ԭ���� ��
��֪��Ksp��BaC2O4��=1.6��10-7��Ksp��CaC2O4��=2.3��10-9
��3�����ü�����ζ����ɲⶨBa2+�ĺ�����ʵ����������С�
��֪��2CrO42—+2H+=Cr2O72—+H20 Ba2++CrO42—=BaCrO4��
����� ��ȡxmlһ��Ũ�ȵ�Na2CrO4��Һ����ƿ�У��������ָʾ������b mol·L��1�����Һ�ζ����յ㣬��õμ��������ΪV0mL��
�������ȡy mLBaCl2��Һ����ƿ�У�����x mL�벽��� ��ͬŨ�ȵ�Na2CrO4��Һ����Ba2+��ȫ�������ټ������ָʾ������b mol·L��1�����Һ�ζ����յ㣬��õμ���������ΪV1mL��
�μ������ҺʱӦ����ʽ�ζ��ܣ���0���̶�λ�ڵζ��ܵ� ����Ϸ������·�������BaCl2��Һ��Ũ��Ϊ mol·L��1����������еμ�����ʱ����������Һ������Ba2+Ũ�Ȳ���ֵ�� ���ƫ��ƫС������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�йء���ʪ�������ӵĸ���ˮ����֬������˵���в���ȷ����
����������
A���õ��ۡ���ά�ص���Ȼ�߷��ӻ��������ϩ�ᡢ����ϩ���ᷢ���ۺϷ�Ӧ�Ƶ�
B���þ���ϩ�����ϩ�ᷴӦ�Ƶ�
C�����Ҷ������Ҷ��ᷢ�����۷�Ӧ�Ƶ�
D������ˮ����֬�Ǻ����Ȼ����ǻ���ǿ��ˮ���Ų�����һ����������״�߷��ӻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��t ��ʱ��AgBr��ˮ�еij����ܽ�ƽ��������ͼ��ʾ����֪t ��ʱAgCl��Ksp��4��10��10������˵������ȷ����(����)
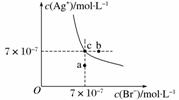
A����t ��ʱ��AgBr��KspΪ4.9��10��13
B����AgBr������Һ�м���NaBr���壬��ʹ��Һ��c��䵽b��
C��ͼ��a���Ӧ����AgBr �IJ�������Һ
D����t ��ʱ��AgCl(s)��Br��(aq)??AgBr(s)��Cl��(aq)��ƽ�ⳣ��K��816
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��������������ǣ�
�����ȶ��ԣ�H2O>HF>H2S ���۵㣺Al>Na>K
�ۢ�A��Ԫ�ص���������������ϡ������Ԫ�ص�ԭ�Ӿ�����ͬ�ĺ�������Ų�
��Ԫ�����ڱ��дӢ�B�嵽��B��10�����е�Ԫ�ض��ǽ���Ԫ��
�ݶ����ԭ���У�����˽Ͻ����������˶��ĵ��������ϸ�
����֪H2SO4(aq)��2NaOH(aq)=2H2O(l)+Na2SO4(aq) ��H= ��114.6kJ��mol��1 ���к���Ϊ57.3kJ��mol��1
�������ǽ���Ԫ��ԭ�Ӽ�ֻ�����γɹ��ۼ�����������Ԫ�صĻ�������һ�������Ӽ�
A���ڢܢ� B���٢ݢ� C���ڢۢ� D���٢ݢ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com