
| A. | 第二周期 IVA族 | B. | 第三周期 IV A族 | C. | 第三周期 VI A族 | D. | 第二周期VI A族 |
分析 该元素5.6g跟氧气充分反应,可得到12g化合物RO2,可知n(O2)=12g-5.6g=6.4g,则n(O2)=$\frac{6.4g}{32g/mol}$=0.2mol,
反应的方程式应为R+O2=RO2,则n(R)=0.2mol,M(R)=$\frac{5.6g}{0.2mol}$=28g/mol,元素R的核外电子数等于核内中子数,则R的质子数应为14,为Si元素,以此解答该题
解答 解:该元素5.6g跟氧气充分反应,可得到12g化合物RO2,
由质量守恒定律可知n(O2)=12g-5.6g=6.4g,则n(O2)=$\frac{6.4g}{32g/mol}$=0.2mol,
反应的方程式应为R+O2=RO2,则n(R)=0.2mol,M(R)=$\frac{5.6g}{0.2mol}$=28g/mol,
元素R的核外电子数等于核内中子数,则R的质子数应为14,为Si元素,
位于周期表第三周期第ⅣA族,
故选B.
点评 本题考查元素的推断,题目难度中等,本题注意根据质量守恒计算元素的相对分子质量,进而计算元素的质子数.


科目:高中化学 来源: 题型:选择题
| A. | Cu→Cu(NO3)2 | B. | C→CO2 | C. | CuO→Cu(NO3)2 | D. | Fe2O3→Fe(NO3)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,3-二甲基丁烷和2-甲基丁烷 | B. | 戊烷和环己烷 | ||
| C. | 丙烷和2-甲基丙烷 | D. | 2,3-二甲基丁烷和和己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol | B. | 1.6mol | C. | 2.2mol | D. | 2.4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


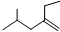 的系统命名4-甲基-2-乙基-1-戊烯
的系统命名4-甲基-2-乙基-1-戊烯查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
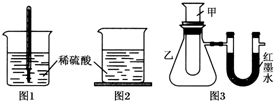
| 序号 | 甲试管里发生反应的物质 | U形管里红墨水液面 |
| ① | 氧化钙与水 | 左低右高 |
| ② | 氢氧化钡晶体与氯化铵晶体(充分搅拌) | ? |
| ③ | 铝片与烧碱溶液 | 左低右高 |
| ④ | 铜与浓硝酸 | 左低右高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com