
| A. | 只有①② | B. | 只有③④ | C. | ①②③④ | D. | 只有①②③ |
科目:高中化学 来源: 题型:解答题
 (1)键线式:
(1)键线式: 表示的分子式C6H14,名称是2-甲基戊烷;
表示的分子式C6H14,名称是2-甲基戊烷;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用浓氨水和氢氧化钠制取氨气 | |
| B. | 加热蒸干AlCl3溶液不能得到无水AlCl3 | |
| C. | 工业上SO2和O2在常压下生成SO3 | |
| D. | 水中的c(H+)比0.1mol/LNaOH溶液中的c(H+)大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一定条件下,反应A(g)?B(g)+C(g) 在2.0L的密闭容器中进行,在T1和T2两个温度下A的物质的量与时间的关系如图所示.下列有关说法正确的是( )
一定条件下,反应A(g)?B(g)+C(g) 在2.0L的密闭容器中进行,在T1和T2两个温度下A的物质的量与时间的关系如图所示.下列有关说法正确的是( )| A. | 正反应△H>0 | |
| B. | 平衡常数K(T2)<K(T1) | |
| C. | T2时,达到平衡时A的转化率为33.3% | |
| D. | T2时,该反应的化学平衡常数为0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
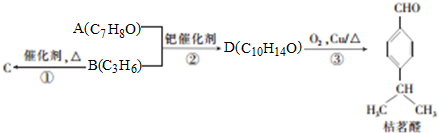
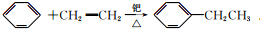 .
.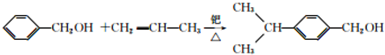 .
.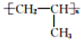 .
.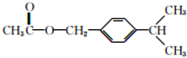 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4g金属镁变为镁离子时失去的电子数为0.2NA | |
| B. | 在标准状况下,11.2L H2O含有水分子的个数为NA | |
| C. | 16g臭氧(O3)中含有氧原子的个数为NA | |
| D. | 1L 1mol/L NaCl溶液中含有Na+的个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
. .
. (写结构简式).
(写结构简式). (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 步骤Ⅰ | 称取样品Wg配成溶液置于锥形瓶中,并调节PH≤2.0 |
| 步骤Ⅱ | 向锥形瓶中加入足量KI晶体,充分搅拌,并加入少量指示剂 |
| 步骤Ⅲ | 用c mol/L的Na2S2O3溶液滴定 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com