
| A. | 用CO2合成聚碳酸酯等可降解塑料,以减少白色污染 | |
| B. | 减少生产、生活中产生的扬尘,以减少雾霾天气的形成 | |
| C. | 加强生活污水的脱氮、除磷处理,以遏制水体的富营养化 | |
| D. | 使用汽车尾气净化器.以减少二氧化碳的排放 |
分析 A.聚乙烯材料难降解,大量使用聚乙烯材料方便袋容易造成白色污染;
B.雾霾天气的形成主要来源于扬尘和化石燃料燃烧产生的颗粒物;
C.生活污水含有大量氮、磷,能够引起各种水生生物、植物异常繁殖和生长,这种现象称作水体富营养化;
D.使用汽车尾气可以使汽车尾气中的一氧化碳和二氧化氮空气污染物转化为不污染空气的氮气和二氧化碳,但不会减少二氧化碳的排放.
解答 解:A.利用二氧化碳等原料合成的聚碳酸酯类可减少难降解的降解塑料聚乙烯材料方便袋的使用,有利于减少白色污染,故A正确;
B.雾霾天气的形成主要来源于化石燃料的燃烧、垃圾焚烧产生的烟尘以及道路和建筑施工的扬尘,所以减少生产生活中产生的扬尘可以减少雾霾天气的形成,故B正确;
C.大量含有各种含氮和磷有机物的废污水排入水中,促使水域富营养化,加强城市生活污水脱氮除磷处理,可遏制水体富营养化,故C正确;
D.使用汽车尾气可以使汽车尾气中的一氧化碳和二氧化氮空气污染物转化为不污染空气的氮气和二氧化碳,但不会减少二氧化碳的排放,故D错误;
故选:D.
点评 本题考查化学环境污染知识,侧重于化学与生活、生产以及环境的考查,明确雾霾、白色污染、水体的富营养化产生原因是解题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 铝制餐具不宜用蒸煮酸性或碱性的食物 | |
| B. | 碳酸钠可用于中和发酵面团中的酸性物质 | |
| C. | 过氧化钠可用于呼吸面具中氧气的来源 | |
| D. | 聚氯乙烯塑料制品可用于食品的包装 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeO | B. | Fe2O3 | C. | Fe3O4 | D. | FeO和Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2≈1.6×10-3 | B. | 2c(Na+)=c(HCN)+c(CN-) | ||
| C. | 混合溶液的pH<7 | D. | 对混合溶液升温,K1增大、K2减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
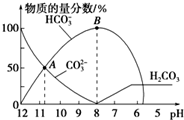 常温下,在10mL0.1mol•L-1Na2CO3溶液中逐渐加入0.1mol•L-1的盐酸,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数的变化如图所示(CO2因逸出未画出,忽略气体逸出而引起的溶液体积变化),下列说法正确的是( )
常温下,在10mL0.1mol•L-1Na2CO3溶液中逐渐加入0.1mol•L-1的盐酸,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数的变化如图所示(CO2因逸出未画出,忽略气体逸出而引起的溶液体积变化),下列说法正确的是( )| A. | 在A点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) | |
| B. | 在B点所示的溶液中,浓度最大的离子是HCO3- | |
| C. | 当溶液的pH为7时,溶液中的阴离子只有两种 | |
| D. | 25℃时,HCO3-的电离平衡常数Ka=5×10-11,当溶液的pH=10时,c(HCO3-)=2c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
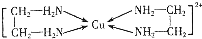 第四周期金属Cr、Fe、Cu在科学研究和工业生产中都有重要的用途.请回答下列问题:
第四周期金属Cr、Fe、Cu在科学研究和工业生产中都有重要的用途.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中Fe2+是还原剂,O2是还原产物 | |
| B. | 4 mol Na2O2在反应中共得到8NA个电子 | |
| C. | 每生成0.2 mol O2,则被Fe2+还原的氧化剂为0.4 mol | |
| D. | 反应过程中可以看到白色沉淀转化为灰绿色再转化为红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
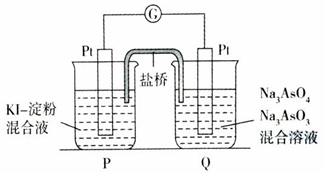
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com