
����Ŀ��ij�����X��A12O3��Fe2O3��Cu��SiO2�е�һ�ֻ���������ɡ�
I.��������ʵ�飺

��ش�
��1������õ���ɫ��Һ���ù�����һ�������Ļ�ѧ��Ӧ�ǣ������ӷ���ʽ��ʾ��______��
��2����ӦII�Ļ�ѧ����ʽ��______________ ��X��һ�����е�������________��
II.Ϊ��һ��ȷ�����������X�ijɷ֣���ȡ9.4gX��������ʵ�顣

��3���������˲������ȱ��ϴ�Ӳ��裬��ʹ�òⶨ�Ĺ���������_______����ƫ��ƫС����Ӱ�죩
��4�������������ɫ��Һ��������Ϊ___________________��5��ԭ�������SiO2��������___________X��һ�������е�������_____________��
���𰸡� Fe2O3+6H+��2Fe3++3H2O��Cu+2Fe3+��2Fe2++Cu2+ SiO2+2NaOH��Na2SiO3+H2O Fe2O3 ��Cu ��SiO2 ƫ�� H�� Cu2�� Fe2�� 3.0g �����X����A12O3
��������9.4gX�������ᷴӦ������ɫ��Һ��˵����Ӧ����Һ�д���ͭ���ӣ����ǽ���Cu�������Ӧ������һ�������������������ᷴӦ���ɵ����������ӿ��Ժͽ���ͭ��Ӧ������������Ժ��������Ʒ�Ӧ��4.92g������������Ʒ�Ӧ��������������3.0g�����Ըù���Ϊ�������裬����Ϊ3.0g���漰�ķ�Ӧ�У�Fe2O3+6H+��2Fe3++3H2O��Cu+2Fe3+��2Fe2++Cu2+��SiO2+2NaOH��Na2SiO3+H2O������ΪCu��NaOH����Ӧ�����1.92g����ֻ��Cu������X��һ�����е�������Fe2O3��Cu��SiO2��9.4gX�����������������Һ��Ӧ��õ�6.4g�����������ٵ�������3.0g���������Ϸ�����֪����������3.0g������ԭ�����в�������������6.4g��������������ᷴӦ�õ���ɫ��Һ����ɫ��Һ�д���ͭ���ӣ������˷�Ӧ��Fe2O3+6H+��2Fe3++3H2O��Cu+2Fe3+��2Fe2++Cu2+��ʣ��1.92g����Ϊͭ��
��1��ͨ�����Ϸ�����֪�����õ���ɫ��Һ���ù�����һ�������Ļ�ѧ��Ӧ��Fe2O3+6H+��2Fe3++3H2O��Cu+2Fe3+��2Fe2++Cu2+����2��ͨ�����Ϸ�����֪��ӦII�Ļ�ѧ����ʽ��SiO2+2NaOH��Na2SiO3+H2O��X��һ�����е�������Fe2O3��Cu��SiO2����3��������������������������������˲������ȱ��ϴ�Ӳ��裬��ʹ�òⶨ�Ĺ���������ƫ������4����Ӧ�����������������������ɫ��Һ��������ΪH����Cu2����Fe2������5��ͨ�����Ϸ�����֪ԭ�������SiO2��������3.0g��X��һ�������е�������A12O3��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.42gNaHCO3��0.53gNa2CO3��ϲ������Һ������Һ�еμ�0.05mol��L-1ϡ���ᡣ����ͼ������ȷ��ʾ������������������CO2�����ʵ����Ĺ�ϵ����
A.  B.
B. 
C.  D.
D. 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ࡢ��֬���������ǻ���Ӫ�����ʡ�����˵����ȷ����
A.���Ǹ߷��ӻ�����
B.��ֻ��C��H��O����Ԫ��
C.��֬����������Ӧ������Ƶ÷���
D.��������������ͬ������������������ʱ�������ʲ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���Һ�Ⱥ���ˮ����������ȷ���ǣ�������
����A��Һ���Ǵ��������ˮ�ǻ���� B��Һ�������ԣ���ˮ������
����C��Һ�Ⱥ���ˮ����Ư���� D��Һ����ɫ����ˮ�ʻ���ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȩ��CH2O�������ᣨC2H4O2���ͱ�ȩ��C3H6O����ɵĻ�����У���Ԫ�ص�����������37%����̼Ԫ�ص���������Ϊ�� ��
A.27%
B.28%
C.54%
D.������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ��ء��Ȼ��ƺ�������ɵĻ����Һ����c (K+)��0.2 mol��L��1��c(Ca2��)��0.4mol��L��1��c(Cl��)��1.2mol��L��1����c(H��)Ϊ
A. 0.15mol��L��1 B. 0.2mol��L��1 C. 0.3mol��L��1 D. 0.4mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��������к�������A��B����֪AΪ��ɫ��ĩ��BΪ��ɫ��ĩ���������±仯��
��1��д�����и����ʵĻ�ѧʽ��A �� B �� C �� D �� G ��
��2��д���١��ڡ��ۡ����Ĵ��仯�Ļ�ѧ����ʽ������
����
����
�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и���������ָ����Һ��һ���ܴ���������ǣ� ��
A.��ʹ�㷺pH��ֽ����ɫ����Һ��K+��Na+��CH3COO����Br��
B.���ȳʺ�ɫ����Һ��NH4+��Ba2+��AlO ![]() ��Cl��
��Cl��
C.0.1 molL��1 FeCl3��Һ��K+��NH![]() ��I����SCN��
��I����SCN��
D.��ˮ�����c ��H+��=1��10��14 molL��1����Һ�У�Ca2+��K+��Cl����HCO ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������㷺��������Ȼ����������ú�����֮�У������ʵ�����ȼ�ϣ����������������Ʒ����Ҫԭ�ϣ�
��1����ȡ����
��֪��CH4��g��+H2O��g��CO��g��+3H2��g����H=+206.2kJmol��1
CH4��g��+CO2��g��2CO��g��+2H2��g����H=+247.4kJmol��1
��i����д��CH4��g����H2O��g����Ӧ����CO2��g����H2��g�����Ȼ�ѧ����ʽ
��ii������0.1mol CH4��0.1mol H2O��g��ͨ�����Ϊ10L���ܱ��������һ�������·�����Ӧ��
CH4��g��+H2O��g��CO��g��+3H2��g����CH4��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ
����֪100��ʱ�ﵽƽ�������ʱ��Ϊ5min������H2��ʾ��ƽ����Ӧ����
�ڸ÷�Ӧ�Ļ�ѧƽ�ⳣ����
��ͼ�е�p1p2�����������������=������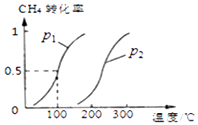
��2���Ʊ��״�
��ѹǿΪ0.1MPa�����£���a mol CO��3amol H2�Ļ�������ڴ������������Է���Ӧ���ɼ״���CO��g��+2H2��g��CH3OH��g����H��0���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ���
A.�����¶�
B.�ٳ���1mol CO��3mol H2
C.��CH3OH��g������ϵ�з���
D.����He��ʹ��ϵ��ѹǿ����
E.ʹ�ø���Ч�Ĵ���
��3���ϳ�����
����ֱ�Ӻϳ����������Ҫ�����������Ӧ�ü�ֵ�������Ӧ����ʹ��CH4�����ѧʽ��ֱ�Ӻϳ����ᣬ�ҷ��ϡ���ɫ��ѧ����Ҫ��ԭ��������100%����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com