
分析 根据反应化学方程式有①2Na+2HCl=2NaCl+H2↑,②Mg+2HCl=MgCl2+H2↑,③2Al+6HCl=2AlCl3+3H2↑,根据各反应物的物质的量结合化学方程式计算,生成氢的物质的量,在相同条件下物质的量之比等于体积之比;根据三种金属的化合价可得与盐酸反应的关系式分别为:Na~$\frac{1}{2}$H2,Mg~H2,Al~$\frac{3}{2}$H2,根据反应的方程式计算三者的大小.
解答 解:分别取0.1mol钠、镁、铝与足量盐酸反应,则:
2Na+2HCl=2NaCl+H2↑、Mg+HCl=MgCl2+H2↑、2Al+6HCl=AlCl3+3H2↑,
0.1mol 0.05mol 0.1mol 0.1mol 0.1mol 0.15mol
故在相同条件下产生氢气的体积比=0.05mol:0.1mol:0.15mol=1:2:3;若将三种金属各0.2mol分别投入10mL1mol/L的盐酸中,可知三种金属都过量,但金属钠活泼,能与水反应生成氢气,则生成氢气最多的是钠,镁和铝生成氢气的体积一样多,故答案为:1:2:3;V1>V2=V3.
点评 本题考查化学方程式的计算,题目难度不大,注意根据化学方程式判断有关反应的量的关系.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:解答题
 某温度下,在2L密闭容器中,发生NO2和N2O4之间的反应:N2O4(g)?2NO2(g),各物质的量随时间的变化关系如图所示,请回答下列问题.
某温度下,在2L密闭容器中,发生NO2和N2O4之间的反应:N2O4(g)?2NO2(g),各物质的量随时间的变化关系如图所示,请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3=Na++HCO3- | B. | H2SO4=2H++SO42- | ||
| C. | Na2S=Na22++S2- | D. | NaHSO4=Na++H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
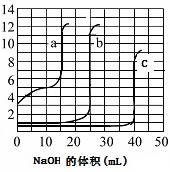
| A. | 由图可知曲线c为NaOH滴定盐酸 | |
| B. | 由图可知曲线a为NaOH滴定盐酸 | |
| C. | 滴定实验可用紫色石蕊试液做指示剂 | |
| D. | 由图可知曲线b为NaOH滴定盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内消耗amolX,同时生产4amolZ | |
| B. | 容器内的氧气不再变化 | |
| C. | Z的生成速率与Y的生成速率比值为1:2 | |
| D. | 容器内气体的密度不发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+ | B. | Cl- | C. | Ag+ | D. | NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾水解时,产生具有吸附性的胶体粒子,可做净水剂 | |
| B. | 用氢氧化铝、碳酸氢钠或烧碱治疗胃酸过多 | |
| C. | 二氧化硫是无色气体,有强烈刺激性气味,是大气主要污染物之一,可以用作食物和干果的防腐剂 | |
| D. | 氯气制备消毒液或漂白粉 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com