
| A. | 质子数为53、中子数为78的碘原子:${\;}_{53}^{131}$I | |
| B. | 乙醇的结构简式:C2H6O | |
| C. | S2-的结构示意图: | |
| D. | 甲烷分子的比例模型是 |
分析 A.元素符号的左上角为质量数;
B.结构简式中需要表示出含有的官能团结构;
C.S原子最外层6个电子,得到2个电子达到稳定结构;
D.比例模型能反映出分子中原子的大小比例关系.
解答 解:A.元素符号的左上角为质量数=质子数+中子数=53+78=131,${\;}_{53}^{131}$I,故A正确;
B.乙醇的结构简式:CH3CH2OH,C2H6O是分子式,故B错误;
C.S原子最外层6个电子,得到2个电子达到稳定结构,S2-的离子结构示意图: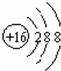 ,故C错误;
,故C错误;
D.甲烷分子的比例模型应该体现出甲烷分子中各原子的相对体积大小, 为甲烷的球棍模型,甲烷的比例模型为:
为甲烷的球棍模型,甲烷的比例模型为: ,故D错误;
,故D错误;
故选A.
点评 本题考查常用化学用语的书写,题目难度不大,掌握常用化学用语的书写,会阴阳离子中核外电子数的计算方法是解本题的关键.


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:选择题
| A. | Cl2>I2>Fe3+>SO2 | B. | Fe3+>Cl2>I2>SO2 | C. | Cl2>Fe3+>I2>SO2 | D. | Cl2>Fe3+>SO2>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当一个可逆反应达到平衡状态时,这就是这个反应所能达到的限度 | |
| B. | 当一个可逆反应达到平衡状态时,这个反应的正向反应速率和逆向反应速率相等,反应也就停止了 | |
| C. | 平衡状态是一种静止的状态,因为反应物和生成物的浓度已经不再改变了 | |
| D. | 化学反应的限度不可以通过改变条件而改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 反应类型 | 反应条件 |
| A | 加成、取代、消去 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
| B | 消去、加成、取代 | NaOH醇溶液/加热、常温、KOH水溶液/加热 |
| C | 氧化、取代、消去 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
| D | 消去、加成、水解 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 青蒿素的分子式是C15H22O5,属于烃的衍生物 | |
| B. | 双氢青蒿素中含有过氧键,遇湿润的淀粉碘化钾试纸立刻显蓝色 | |
| C. | 蒿甲醚可以发生水解反应 | |
| D. | 反应②为取代反应,有H2O生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料.实验室用下列反应制取肉桂酸.
肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料.实验室用下列反应制取肉桂酸.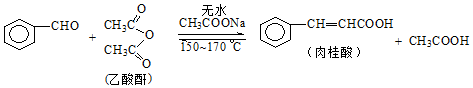
| 苯甲醛 | 乙酸酐 | 肉桂酸 | 乙酸 | |
| 溶解度(25℃,g/100g水) | 0.3 | 遇热水水解 | 0.04 | 互溶 |
| 沸点(℃) | 179.6 | 138.6 | 300 | 118 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com