
| A. | CH2═CH2+HCl$→_{△}^{催化剂}$CH3CH2Cl | |
| B. | 2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH | |
| C. |  +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$ -Br+HBr -Br+HBr | |
| D. | CH3CH2Br+NaOH$→_{△}^{乙醇}$CH2═CH2↑+NaBr+H2O |
分析 A.碳碳双键转化为单键;
B.-CHO转化为-COOH;
C.苯环上H被Br取代;
D.-Br转化为碳碳双键.
解答 解:A.CH2═CH2+HCl$→_{△}^{催化剂}$CH3CH2Cl为加成反应,故A不选;
B.2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH为氧化反应,故B不选;
C. +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$ -Br+HBr为取代反应,故C选;
-Br+HBr为取代反应,故C选;
D.CH3CH2Br+NaOH$→_{△}^{乙醇}$CH2═CH2↑+NaBr+H2O为消去反应,故D不选;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质、有机反应为解答关键,侧重分析与应用能力的考查,注意反应中官能团的变化,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 该物质一定是钠的化合物 | B. | 该物质一定含钠元素 | ||
| C. | 该物质一定是金属钠 | D. | 该物质中一定含钠离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有大量Ba(NO3 )2的溶液中:Mg2+、NH4+、SO42-、Cl- | |
| B. | 无色透明的溶液中:Cu2+、K+、SO42-、NO3- | |
| C. | 在碱性溶液中:Na+、K+、SO42-、CO32- | |
| D. | 在酸性的溶液中:Na+、K+、CO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
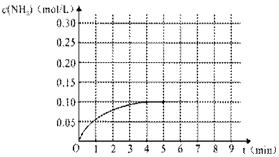 在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g )△H<0,反应中NH3的物质的量浓度的变化的情况如图:
在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g )△H<0,反应中NH3的物质的量浓度的变化的情况如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 纯净物 | 混合物 | 碱性氧化物 | 非电解质 |
| A | 液氯 | 漂白粉 | Al2O3 | CO |
| B | 纯碱 | 浓硫酸 | CaO | 乙醇 |
| C | 碱石灰 | 王水 | K2O | Cl2 |
| D | 胆矾 | 水玻璃 | Na2O2 | SO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤时,用玻璃棒搅动滤纸中的液体 | |
| B. | 做钠的焰色反应实验可用玻璃棒蘸取少量NaCl的浓溶液在无色火焰上灼烧 | |
| C. | 配制溶液过程中定容摇匀后发现液面低于容量瓶的刻度线,再用胶头滴管加水至刻度线 | |
| D. | 用自来水制蒸馏水时,弃去开始馏出的部分液体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com